El 1-propanol (también propan-1-ol , propanol , alcohol n-propílico ) es un alcohol primario con la fórmula CH3CH2CH2OH y a veces representado como PrOH o n -PrOH . Es un líquido incoloro y un isómero del 2-propanol . El 1-propanol se utiliza como disolvente en la industria farmacéutica, principalmente para resinas y ésteres de celulosa y, a veces, como agente desinfectante .
Los alcoholes fusel como el 1-propanol son subproductos de la fermentación de granos y, por lo tanto, existen trazas de 1-propanol en muchas bebidas alcohólicas .
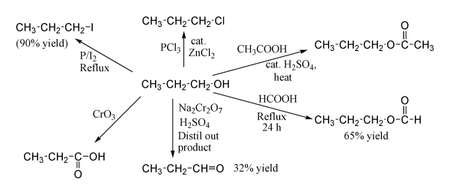
El 1-propanol muestra las reacciones normales de un alcohol primario . Por lo tanto, se puede convertir en haluros de alquilo ; por ejemplo, el fósforo rojo y el yodo producen yoduro de n-propilo con un rendimiento del 80%, mientras que el PCl3 con ZnCl2 catalítico da cloruro de n-propilo . La reacción con ácido acético en presencia de un catalizador de H2SO4 en condiciones de esterificación de Fischer da acetato de propilo , mientras que el reflujo de propanol durante la noche con ácido fórmico solo puede producir formiato de propilo con un rendimiento del 65%. La oxidación de 1-propanol con Na2Cr2O7 y H2SO4 da un rendimiento del 36% de propionaldehído y, por lo tanto , para este tipo de reacción se recomiendan métodos de mayor rendimiento que utilicen PCC o la oxidación de Swern . La oxidación con ácido crómico produce ácido propiónico .
El 1-propanol se fabrica mediante la hidrogenación catalítica del propionaldehído . El propionaldehído se produce mediante el proceso oxo por hidroformilación del etileno utilizando monóxido de carbono e hidrógeno en presencia de un catalizador como el octacarbonilo de cobalto o un complejo de rodio . [5]
Una preparación tradicional de laboratorio de 1-propanol implica el tratamiento del yoduro de n -propilo con Ag 2 O húmedo .
Se cree que el 1-propanol tiene efectos similares al etanol en el cuerpo humano, pero de 2 a 4 veces más potente según un estudio realizado en conejos. Muchos estudios toxicológicos encuentran una DL50 aguda oral que varía de 1,9 g/kg a 6,5 g/kg (en comparación con 7,06 g/kg para el etanol). Se metaboliza en ácido propiónico . Los efectos incluyen intoxicación alcohólica y acidosis metabólica con brecha aniónica alta . En 2011, se informó de un caso de envenenamiento letal tras la ingestión oral de 500 ml de 1-propanol. [6] Debido a la falta de datos a largo plazo, se desconoce la carcinogenicidad del 1-propanol en humanos.
El 1-propanol tiene un índice de octano alto y es adecuado para su uso como combustible para motores . Sin embargo, el propanol es demasiado caro para su uso como combustible para motores. El índice de octano (RON) de investigación del propanol es 118 y el índice antidetonante (AKI) es 108. [7]