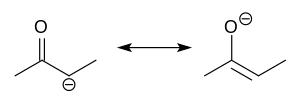
En química orgánica , los enolatos son aniones orgánicos derivados de la desprotonación de compuestos carbonílicos ( RR'C=O ). Raramente aislados, se utilizan ampliamente como reactivos en la síntesis de compuestos orgánicos . [1] [2] [3] [4]

Los aniones enolato están relacionados electrónicamente con los aniones alilo. La carga aniónica está deslocalizada sobre el oxígeno y los dos sitios de carbono. Por lo tanto, tienen el carácter tanto de un alcóxido como de un carbanión . [5]
Aunque a menudo se las representa como sales simples, en realidad adoptan estructuras complicadas que a menudo presentan agregados. [6]

La desprotonación de cetonas enolizables, alcoholes aromáticos, aldehídos y ésteres produce enolatos. [8] [9] Con bases fuertes, la desprotonación es cuantitativa. Normalmente, los enolatos se generan a partir de diisopropilamida de litio (LDA). [10]
A menudo, como en las condensaciones de Claisen convencionales , las reacciones de Mannich y las condensaciones aldólicas , los enolatos se generan en bajas concentraciones con bases de alcóxido. En tales condiciones, existen en bajas concentraciones, pero aún experimentan reacciones con electrófilos. Muchos factores afectan el comportamiento de los enolatos, especialmente el disolvente, los aditivos (por ejemplo, diaminas) y el contracatión (Li + frente a Na + , etc.). Para las cetonas asimétricas, existen métodos para controlar la regioquímica de la desprotonación. [11]

La desprotonación de ácidos carbonados puede proceder con un control de reacción cinético o termodinámico . Por ejemplo, en el caso de la fenilacetona , la desprotonación puede producir dos enolatos diferentes. Se ha demostrado que la LDA desprotona el grupo metilo, que es el curso cinético de la desprotonación. Para asegurar la producción del producto cinético, se utiliza un ligero exceso (1,1 equiv) de diisopropilamida de litio y se añade la cetona a la base a -78 °C. Debido a que la cetona se convierte rápida y cuantitativamente en el enolato y la base está presente en exceso en todo momento, la cetona no puede actuar como un transbordador de protones para catalizar la formación gradual del producto termodinámico. Una base más débil, como un alcóxido , que desprotona reversiblemente el sustrato, proporciona el enolato bencílico más estable termodinámicamente.
Los enolatos pueden quedar atrapados por acilación y sililación , que ocurren en presencia de oxígeno. Los éteres de sililo enol son reactivos comunes en la síntesis orgánica, como lo ilustra la reacción aldólica de Mukaiyama : [13]

Además del uso de bases fuertes, los enolatos se pueden generar utilizando un ácido de Lewis y una base débil ("condiciones blandas"):

Para que se produzca la desprotonación , el requisito estereoelectrónico es que el enlace sigma alfa-CH debe poder superponerse con el orbital pi* del carbonilo :
Se han realizado estudios exhaustivos sobre la formación de enolatos. Es posible controlar la geometría del enolato: [14]

En el caso de las cetonas, la mayoría de las condiciones de enolización dan enolatos Z. En el caso de los ésteres , la mayoría de las condiciones de enolización dan enolatos E. Se sabe que la adición de HMPA revierte la estereoselectividad de la desprotonación.

La formación estereoselectiva de enolatos se ha racionalizado con el modelo de Ireland [15] [ 16] [17] [18] , aunque su validez es algo cuestionable. En la mayoría de los casos, no se sabe qué intermediarios, si los hay, son de naturaleza monomérica u oligomérica ; no obstante, el modelo de Ireland sigue siendo una herramienta útil para comprender los enolatos.

En el modelo de Ireland, se supone que la desprotonación se produce mediante un estado de transición monomérico de seis miembros o cíclico [19] . El mayor de los dos sustituyentes en el electrófilo (en el caso anterior, el metilo es más grande que el protón) adopta una disposición ecuatorial en el estado de transición favorecido, lo que conduce a una preferencia por los enolatos E. El modelo claramente falla en muchos casos; por ejemplo, si la mezcla de solventes se cambia de THF a 23% HMPA-THF (como se ve arriba), la geometría del enolato se invierte, lo que es inconsistente con este modelo y su estado de transición cíclico.
Si una cetona asimétrica se somete a una base, tiene el potencial de formar dos enolatos regioisoméricos (sin tener en cuenta la geometría del enolato). Por ejemplo:

El enolato trisustituido se considera el enolato cinético , mientras que el enolato tetrasustituido se considera el enolato termodinámico. El hidrógeno alfa desprotonado para formar el enolato cinético está menos impedido y, por lo tanto, se desprotona más rápidamente. En general, las olefinas tetrasustituidas son más estables que las olefinas trisustituidas debido a la estabilización hiperconjugativa. La relación de regioisómeros de enolato está muy influenciada por la elección de la base. Para el ejemplo anterior, el control cinético se puede establecer con LDA a −78 °C, lo que da una selectividad de 99:1 de enolato cinético:termodinámico, mientras que el control termodinámico se puede establecer con trifenilmetillitio a temperatura ambiente , lo que da una selectividad de 10:90.
En general, los enolatos cinéticos se ven favorecidos por temperaturas frías, condiciones que dan un enlace metal-oxígeno relativamente iónico y una desprotonación rápida utilizando un ligero exceso de una base fuerte estéricamente impedida. La base grande solo desprotona el hidrógeno más accesible, y las bajas temperaturas y el exceso de base ayudan a evitar el equilibrio al enolato alternativo más estable después de la formación inicial del enolato. Los enolatos termodinámicos se ven favorecidos por tiempos de equilibrio más largos a temperaturas más altas, condiciones que dan un enlace metal-oxígeno relativamente covalente y el uso de una ligera cantidad subestequiométrica de base fuerte. Al utilizar una base insuficiente para desprotonar todas las moléculas de carbonilo, los enolatos y carbonilos pueden intercambiar protones entre sí y equilibrarse a su isómero más estable. El uso de varios metales y disolventes puede proporcionar control sobre la cantidad de carácter iónico en el enlace metal-oxígeno.
Como potentes nucleófilos, los enolatos reaccionan con una variedad de electrófilos. La estereoselectividad y regioselectividad se ve influida por aditivos, disolventes, contraiones , etc. Cuando los electrófilos son haluros de alquilo, surge un problema clásico: O-alquilación frente a C-alquilación . El control de esta selectividad ha llamado mucho la atención. La carga negativa de los enolatos se concentra en el oxígeno, pero ese centro también está muy solvatado, lo que conduce a la C-alquilación. [20]
Otros electrófilos importantes son los aldehídos/cetonas y los aceptores de Michael . [21]
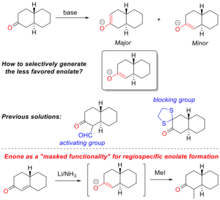

La formación regioespecífica es la formación controlada de enolato mediante la desprotonación específica en uno de los carbonos α de la molécula de partida de la cetona. Esto proporciona una de las estrategias sintéticas mejor comprendidas para introducir complejidad química en productos naturales y síntesis totales . Un ejemplo destacado de su uso es la síntesis total de progesterona, ilustrada en la Figura "Formación regioespecífica de enolato en la síntesis total de progesterona".
Cuando se tratan las cetonas con una base , se pueden formar enolatos por desprotonación en cualquiera de los carbonos α. La selectividad está determinada tanto por los efectos estéricos como electrónicos en los carbonos α, así como por la base precisa utilizada (véase la figura ""Funcionalidad enmascarada" para la formación de enolatos regioespecíficos" para un ejemplo de esto). La formación de enolatos se verá favorecida termodinámicamente en el protón más ácido, lo que depende de la estabilización electrónica del anión resultante . Sin embargo, la selectividad se puede revertir obstaculizando estéricamente el producto termodinámico y, por lo tanto, favoreciendo cinéticamente la desprotonación en el otro centro de carbono α. Los métodos tradicionales para la formación regioselectiva de enolatos utilizan grupos activadores electrónicos (p. ej., aldehídos ) o grupos bloqueantes estéricos (p. ej., cetona protegida con 1,2-etanoditiol ).
Una enona también puede servir como precursora para la formación regioespecífica de un enolato, en este caso la enona es una "funcionalidad enmascarada" para el enolato. Este proceso fue descrito por primera vez por Gilbert Stork [22] , quien es mejor conocido por sus contribuciones al estudio de los métodos de formación selectiva de enolatos en síntesis orgánica . La reacción de una enona con litio metálico genera el enolato en el carbono α de la enona. El producto enolato puede ser atrapado o alquilado. Al utilizar la "funcionalidad enmascarada", es posible producir enolatos que no son accesibles por los métodos tradicionales.
El enfoque de "funcionalidad enmascarada" para la formación de enolatos regioespecíficos se ha utilizado ampliamente en la síntesis total de productos naturales. Por ejemplo, en la síntesis total de la hormona esteroide progesterona , [23] Stork y sus colaboradores utilizaron la "funcionalidad enmascarada" para construir de forma estereoespecífica uno de los carbonos cuaternarios de la molécula.
Los enolatos de aza (también conocidos como aniones imina, enamidas, bases de Schiff metaladas y metaloenaminas) son análogos nitrogenados de los enolatos. [24] Cuando las iminas se tratan con bases fuertes como LDA , se generan enolatos de aza altamente nucleofílicos.

El principal beneficio de usar enolatos de aza es que no sufren autocondensación (es decir, reacción aldólica para aldehídos ) en una solución básica o neutra, sino que favorecen la alquilación en el carbono alfa. [25] Esto se debe principalmente a que las iminas contienen dobles enlaces carbono-nitrógeno a diferencia de los aldehídos, que contienen dobles enlaces oxígeno-carbono. Dado que el oxígeno es más electronegativo que el nitrógeno, retira más densidad electrónica del carbono carbonílico, induciendo una mayor carga parcialmente positiva en el carbono. Por lo tanto, con más carbono electrofílico, los aldehídos permiten una mejor adición nucleofílica al carbono en el doble enlace carbono-oxígeno.
Por otra parte, la imina tiene menos nitrógeno electronegativo , lo que induce una carga parcialmente positiva más débil en el carbono carbonílico. Como resultado, si bien las iminas aún pueden reaccionar con organolitios, no reaccionan con otros nucleófilos (incluidos los aza enolatos) para experimentar adiciones nucleofílicas . [26]
En cambio, los enolatos de aza reaccionan de manera similar a los enolatos, formando productos alquilados SN2 . [25] A través de la conjugación de pares solitarios de nitrógeno, el carbono β se convierte en un sitio nucleofílico, lo que permite que los enolatos de aza experimenten reacciones de alquilación. [27] Por lo tanto, los enolatos de aza pueden reaccionar con numerosos electrófilos como epóxidos y haluros de alquilo para formar un nuevo enlace carbono-carbono en el carbono β. [24]
A continuación se muestran dos posibles mecanismos de reacción:

Dado que el epóxido es una molécula de anillo de tres miembros, tiene un alto grado de tensión de anillo . Aunque los carbonos en el sistema de anillo son tetraédricos , prefiriendo 109,5 grados entre cada átomo, el epóxido tensa los ángulos del anillo a 60 grados. Para contrarrestar este efecto, los enolatos de aza nucleófilos reaccionan fácilmente con los epóxidos para reducir sus tensiones de anillo.

Además de reaccionar con epóxidos, los enolatos de aza también pueden reaccionar con haluros de alquilo (o haluros de alilo como se muestra arriba) para formar un nuevo enlace sigma carbono-carbono . Esta reacción es uno de los pasos clave en la síntesis de la feromona de agresión masculina, Oulema melanopus. [29] El enolato de aza se genera cuando LDA reacciona con pivaldehído, que luego reacciona con un haluro de alquilo para formar un intermediario de Oulema melanopus.
Los enolatos de aza también se pueden formar con reactivos de Grignard y reaccionar con otros electrófilos blandos, incluidos los receptores de Michael . [24]