La epoxidación de Shi es una reacción química descrita como la epoxidación asimétrica de alquenos con oxona (peroximonosulfato de potasio) y un catalizador derivado de la fructosa ( 1 ). Se cree que esta reacción se produce a través de un intermedio de dioxirano , generado a partir de la cetona catalizadora por oxona (peroximonosulfato de potasio). La adición del grupo sulfato por la oxona facilita la formación del dioxirano al actuar como un buen grupo saliente durante el cierre del anillo. Es notable por su uso de un catalizador no metálico y representa un ejemplo temprano de organocatálisis . [3] [4]

La reacción fue reportada por primera vez por Yian Shi (史一安, pinyin : Shǐ Yī-ān) de la Universidad Estatal de Colorado en 1996. La mayoría de los candidatos a catalizadores sufren de una rápida descomposición/oxidación del intermedio dioxirano y falta de electrofilicidad de la cetona reactiva. Se propusieron cetonas aromáticas, y muchas variaciones posteriores de sales de oxoamonio demostraron ser ineficaces para promover la epoxidación debido a la inestabilidad oxidativa de los grupos amida y la alta flexibilidad de los anillos de siete miembros. La enantioselectividad de estos primeros catalizadores también se redujo debido a las grandes distancias entre las subunidades asimétricas y los centros de reacción, lo que produjo menos del 10 por ciento en exceso enantiomérico . [5]
El catalizador descubierto por Yian Shi se deriva de la D-fructosa y tiene un centro estereogénico cerca del centro de reacción (cetona); la estructura de anillo rígido de seis miembros del catalizador y el grupo de anillo cuaternario adyacente minimizan la epimerización de este estereocentro. La oxidación por el catalizador de dioxirano activo se lleva a cabo desde la cara si , debido al impedimento estérico de la cara opuesta. Este catalizador funciona eficientemente como un catalizador asimétrico para trans-olefinas no funcionalizadas. [6]

En condiciones normales de pH, se necesita un exceso de 3 cantidades estequiométricas de catalizador de cetona debido a una alta tasa de descomposición. En condiciones de pH básico mayores de 10 (pH 10,5) se necesitan cantidades subestequiométricas (0,2-0,3) para las epoxidaciones, lo que reduce la descomposición de los reactivos al desfavorecer la reacción secundaria de Baeyer-Villiger. Las temperaturas más altas dan como resultado una mayor descomposición; por lo tanto, se utiliza una temperatura baja de cero grados Celsius.

La descomposición de los reactivos es bimolecular ( velocidad de reacción de segundo orden ), por lo que se utilizan bajas cantidades de oxona y catalizador.
La reacción está mediada por un catalizador derivado de la D-fructosa, que produce el enantiómero (R,R) del epóxido resultante. Las solubilidades del sustrato orgánico de olefina y del oxidante (oxona) difieren, y por lo tanto se necesita un medio bifásico . La generación de la especie catalizadora activa tiene lugar en la capa acuosa y se transporta a la capa orgánica con los reactivos mediante sulfato de tetrabutilamonio. El catalizador de cetona se regenera continuamente en un ciclo catalítico y, por lo tanto, puede catalizar la epoxidación en pequeñas cantidades.
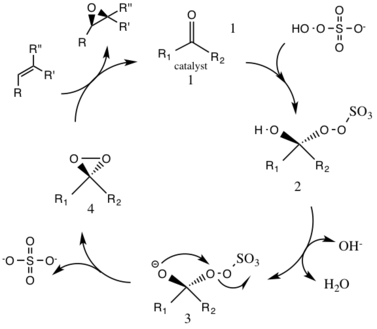
El primer paso en la reacción del ciclo catalítico es la reacción de adición nucleofílica de la oxona con el grupo cetona del catalizador (intermedio 1). Esto forma la especie reactiva intermedia número 2, el intermedio de Criegee que puede conducir potencialmente a reacciones secundarias no deseadas, como la reacción de Baeyer-Villiger (ver más abajo). La generación de la especie intermedia número 3 ocurre bajo condiciones básicas, con una eliminación del hidrógeno del grupo hidroxi para formar un anión de oxígeno nucleofílico. El grupo sulfato facilita la formación posterior del dioxirano, especie intermedia número 4, al actuar como un buen grupo saliente durante la ciclización 3-exo-tet . La especie catalítica de dioxirano activada luego transfiere un átomo de oxígeno al alqueno, lo que conduce a una regeneración del catalizador original. [7]
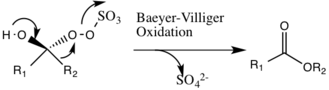
Una posible reacción secundaria que puede ocurrir es la reacción de Baeyer-Villiger del intermedio 2, donde hay una reorganización del grupo peroxi que da como resultado la formación del éster relativo. La magnitud de esta reacción secundaria disminuye con el aumento del pH y aumenta la nucleofilia de la oxona, lo que hace que las condiciones básicas sean favorables para la epoxidación general y la reactividad de las especies catalíticas.
El oxígeno del grupo dioxirano generado en el catalizador orgánico se transfiere al alqueno, en lo que se cree que es un mecanismo concertado, aunque puede ocurrir la presencia de un anión de oxígeno intermedio a través de un mecanismo S n 2 .

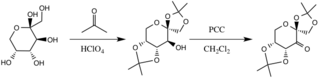
El catalizador se forma por reacción con acetona en condiciones básicas, con los grupos hidroxilo del anillo de fructosa actuando como nucleófilos, su nucleofilia aumentada por las condiciones básicas creadas por el carbonato de potasio . Los sustituyentes que atraen electrones (grupos alfa-éter) fomentan la formación de la cetona a partir del agente oxidante clorocromato de piridinio al aumentar la electrofilia del carbono carbonílico, a través de una deslocalización estabilizadora de los enlaces π CC en formación en los enlaces σ* CO de los éteres adyacentes. [8]
Se han propuesto dos estados de transición , cuyas geometrías son especulativas y no están corroboradas por evidencia experimental, pero se atribuyen a efectos estereoelectrónicos . El estado de transición espiro se favorece sobre el planar debido a que los orbitales no enlazantes del oxígeno superior donan en los orbitales CC antienlazantes π* del alqueno que reacciona, lo que proporciona una deslocalización estabilizadora de los electrones.
La donación de estos electrones a los enlaces CO σ que se forman en los enlaces epóxido también fomenta la formación del producto espiro (la geometría del producto también está alineada). La configuración plana es desfavorable debido a la falta de enlaces posteriores pi y al impedimento estérico de los grupos alquilo con grupos funcionales alquilo grandes del anillo catalítico. [9]
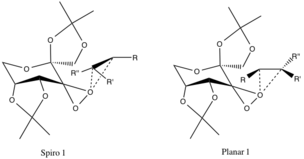
Las configuraciones mencionadas anteriormente se favorecen sobre los estados de transición de los enantiómeros opuestos debido a interacciones estéricas desfavorables entre los grupos R-alquilo (ver a continuación) y los grupos funcionales éter-alquilo del anillo catalizador.

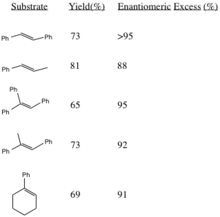
El éxito enantiomérico de esta epoxidación es relativamente alto en comparación con los catalizadores metálicos y generalmente da como resultado un exceso enantiomérico alto que supera el 80 por ciento. [10]
Este procedimiento genera epóxidos con altos excesos enantioméricos a partir de alquenos trans-disustituidos y alquenos trisustituidos. Los alquenos cis-disustituidos [11] y los estirenos [12] se epoxidan asimétricamente utilizando un catalizador similar. La generación de epóxidos (R,R) a partir de los alquenos correspondientes aumenta en estereoselectividad con un mayor volumen estérico de los grupos R sustituyentes (especialmente en olefinas trans).