El cloruro de estaño (II) , también conocido como cloruro estannoso , es un sólido cristalino blanco con la fórmula SnCl2 . Forma un dihidrato estable , pero las soluciones acuosas tienden a sufrir hidrólisis , particularmente si están calientes. El SnCl2 se usa ampliamente como agente reductor (en solución ácida) y en baños electrolíticos para el estañado . El cloruro de estaño (II) no debe confundirse con el otro cloruro de estaño; cloruro de estaño (IV) o cloruro estánnico (SnCl4 ) .
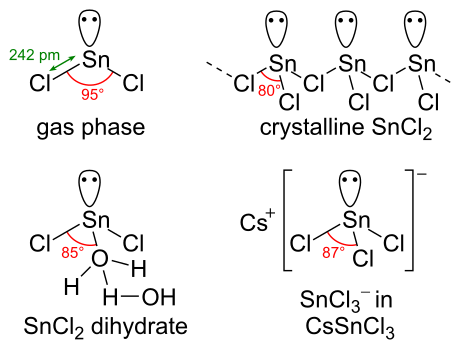
El SnCl2 tiene un par solitario de electrones , de modo que la molécula en la fase gaseosa está doblada. En el estado sólido, el SnCl2 cristalino forma cadenas unidas a través de puentes de cloruro como se muestra. El dihidrato también tiene tres coordenadas, con una agua en la lata y otra agua en la primera. La parte principal de la molécula se apila en capas dobles en la red cristalina , con la "segunda" agua intercalada entre las capas.

El cloruro de estaño (II) puede disolverse en menos que su propia masa de agua sin descomposición aparente, pero a medida que la solución se diluye, se produce hidrólisis para formar una sal básica insoluble:
Por lo tanto, si se utilizan soluciones claras de cloruro de estaño (II), se debe disolver en ácido clorhídrico (normalmente de la misma o mayor molaridad que el cloruro estannoso) para mantener el equilibrio hacia el lado izquierdo (utilizando el principio de Le Chatelier ). Las soluciones de SnCl 2 también son inestables a la oxidación por el aire:
Esto se puede evitar almacenando la solución sobre trozos de estaño metálico. [4]
Hay muchos casos en los que el cloruro de estaño (II) actúa como agente reductor, reduciendo las sales de plata y oro al metal, y las sales de hierro (III) a hierro (II), por ejemplo:
También reduce el cobre (II) a cobre (I).
Las soluciones de cloruro de estaño(II) también pueden servir simplemente como fuente de iones Sn2 + , que pueden formar otros compuestos de estaño(II) mediante reacciones de precipitación . Por ejemplo, la reacción con sulfuro de sodio produce sulfuro de estaño(II) de color marrón/negro :
Si se agrega álcali a una solución de SnCl 2 , inicialmente se forma un precipitado blanco de óxido de estaño (II) hidratado ; este luego se disuelve en un exceso de base para formar una sal de estannita, como la estannita de sodio:
El SnCl2 anhidro se puede utilizar para elaborar una variedad de compuestos interesantes de estaño(II) en disolventes no acuosos. Por ejemplo, la sal de litio del 4-metil-2,6-di-terbutilfenol reacciona con SnCl2 en THF para dar el compuesto bicoordinado lineal amarillo Sn(OAr) 2 (Ar = arilo ). [5]
El cloruro de estaño (II) también se comporta como un ácido de Lewis , formando complejos con ligandos como el ion cloruro , por ejemplo:
La mayoría de estos complejos son piramidales y, dado que los complejos como SnCl−
3Si tienen un octeto completo , hay poca tendencia a agregar más de un ligando. Sin embargo, el par solitario de electrones en tales complejos está disponible para la unión y, por lo tanto, el complejo en sí puede actuar como una base de Lewis o ligando. Esto se ve en el producto relacionado con el ferroceno de la siguiente reacción:
El SnCl2 se puede utilizar para elaborar una variedad de compuestos que contienen enlaces metal-metal. Por ejemplo, la reacción con dicobalto octacarbonilo :
El SnCl2 anhidro se prepara mediante la acción del gas cloruro de hidrógeno seco sobre el estaño metálico. El dihidrato se obtiene mediante una reacción similar, utilizando ácido clorhídrico :
Luego, el agua se evapora cuidadosamente de la solución ácida para producir cristales de SnCl 2 ·2H 2 O. Este dihidrato se puede deshidratar hasta la anhidratación utilizando anhídrido acético . [6]
Para el estañado del acero, con el fin de fabricar latas de hojalata , se utiliza una solución de cloruro de estaño (II) que contiene un poco de ácido clorhídrico . Se aplica un potencial eléctrico y se forma estaño metálico en el cátodo mediante electrólisis .
El cloruro de estaño (II) se utiliza como mordiente en el teñido de textiles porque da colores más brillantes a algunos tintes, por ejemplo, la cochinilla . Este mordiente también se ha utilizado solo para aumentar el peso de la seda.
En los últimos años, un número cada vez mayor de marcas de pasta de dientes han añadido cloruro de estaño (II) a su fórmula como protección contra la erosión del esmalte, por ejemplo, Oral-B o Elmex .
Se utiliza como catalizador en la producción del plástico ácido poliláctico (PLA).
También se utiliza como catalizador entre la acetona y el peróxido de hidrógeno para formar la forma tetramérica del peróxido de acetona .
El cloruro de estaño (II) también se utiliza ampliamente como agente reductor . Esto se puede ver en su uso para platear espejos, donde el metal plateado se deposita sobre el vidrio:
Tradicionalmente se ha utilizado una reducción relacionada como prueba analítica para Hg 2+ (aq) . Por ejemplo, si se añade SnCl 2 gota a gota a una solución de cloruro de mercurio (II) , primero se forma un precipitado blanco de cloruro de mercurio (I) ; a medida que se añade más SnCl 2 , este se vuelve negro a medida que se forma mercurio metálico.
Muchos aficionados y profesionales de la refinación de metales preciosos también utilizan el cloruro estannoso para comprobar la presencia de sales de oro . [7] Cuando el SnCl 2 entra en contacto con compuestos de oro, en particular sales de cloroaurato , forma un coloide de color púrpura brillante conocido como púrpura de Casio . [8] Una reacción similar ocurre con las sales de platino y paladio , que se vuelven verdes y marrones respectivamente. [9]
Cuando se analiza el mercurio mediante espectroscopia de absorción atómica, se debe utilizar un método de vapor frío y normalmente se utiliza cloruro de estaño (II) como reductor.
En química orgánica , el SnCl 2 se utiliza principalmente en la reducción de Stephen , mediante la cual un nitrilo se reduce (a través de una sal de cloruro de imidoilo ) a una imina que se hidroliza fácilmente a un aldehído . [10]
La reacción suele funcionar mejor con nitrilos aromáticos Aryl -CN. Una reacción relacionada (llamada método de Sonn-Müller) comienza con una amida, que se trata con PCl 5 para formar la sal de cloruro de imidoilo.

La reducción de Stephen se utiliza menos hoy en día, porque ha sido reemplazada en gran medida por la reducción con hidruro de diisobutilaluminio .
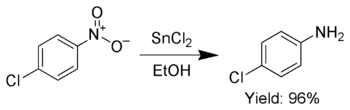
Además, el SnCl2 se utiliza para reducir selectivamente los grupos nitro aromáticos a anilinas . [11]
El SnCl2 también reduce las quinonas a hidroquinonas .
El cloruro estannoso también se agrega como aditivo alimentario con el número E E512 a algunos alimentos enlatados y embotellados, donde actúa como agente de retención de color y antioxidante .
El SnCl 2 se utiliza en la angiografía con radionúclidos para reducir el agente radiactivo tecnecio -99m- pertecnetato y ayudar a su unión a las células sanguíneas.
El SnCl2 fundido se puede oxidar para formar nanoestructuras de SnO2 altamente cristalinas . [ 12] [13]
La reducción con estaño se utiliza en las exploraciones óseas de medicina nuclear para eliminar la carga negativa del pertecnetato libre cuando está unido a MDP para estudios radiofarmacéuticos. La reducción incompleta debido a una cantidad insuficiente de estaño o a una insuflación accidental de aire conduce a la formación de pertecnetato libre, un hallazgo que se puede observar en las exploraciones óseas debido a su absorción inadecuada en el estómago. [14]