
En química orgánica , el acoplamiento de Kumada es un tipo de reacción de acoplamiento cruzado , útil para generar enlaces carbono-carbono mediante la reacción de un reactivo de Grignard y un haluro orgánico. El procedimiento utiliza catalizadores de metales de transición , normalmente níquel o paladio, para acoplar una combinación de dos grupos alquilo , arilo o vinilo . Los grupos de Robert Corriu y Makoto Kumada informaron de la reacción de forma independiente en 1972. [1] [2]
La reacción se destaca por estar entre los primeros métodos de acoplamiento cruzado catalítico informados. A pesar del desarrollo posterior de reacciones alternativas ( Suzuki , Sonogashira , Stille , Hiyama , Negishi ), el acoplamiento Kumada continúa empleándose en muchas aplicaciones sintéticas , incluida la producción a escala industrial de aliskiren , un medicamento para la hipertensión , y politiofenos , útiles en compuestos orgánicos. dispositivos electrónicos.
Las primeras investigaciones sobre el acoplamiento catalítico de reactivos de Grignard con haluros orgánicos se remontan al estudio de 1941 sobre catalizadores de cobalto realizado por Morris S. Kharasch y EK Fields. [3] En 1971, Tamura y Kochi desarrollaron este trabajo en una serie de publicaciones que demostraban la viabilidad de catalizadores basados en plata, [4] cobre [5] y hierro. [6] Sin embargo, estos primeros enfoques produjeron bajos rendimientos debido a la formación sustancial de productos de homoacoplamiento, donde se acoplan dos especies idénticas.
Estos esfuerzos culminaron en 1972, cuando los grupos Corriu y Kumada informaron simultáneamente sobre el uso de catalizadores que contenían níquel. Con la introducción de los catalizadores de paladio en 1975 por parte del grupo Murahashi, el alcance de la reacción se amplió aún más. [7] Posteriormente, se han desarrollado muchas técnicas de acoplamiento adicionales, que culminaron en el Premio Nobel de Química de 2010, que reconoció a Ei-ichi Negishi , Akira Suzuki y Richard F. Heck por sus contribuciones al campo.

Según el mecanismo ampliamente aceptado, se entiende que el acoplamiento de Kumada catalizado por paladio es análogo al papel del paladio en otras reacciones de acoplamiento cruzado. El ciclo catalítico propuesto involucra estados de oxidación de paladio (0) y paladio (II). Inicialmente, el catalizador de Pd(0) rico en electrones ( 1 ) se inserta en el enlace R-X del haluro orgánico. Esta adición oxidativa forma un complejo orgánico de Pd (II) ( 2 ). La transmetalación posterior con el reactivo de Grignard forma un complejo heteroorganometálico ( 3 ). Antes del siguiente paso, es necesaria la isomerización para colocar los ligandos orgánicos uno al lado del otro en posiciones mutuamente cis. Finalmente, la eliminación reductora de ( 4 ) forma un enlace carbono-carbono y libera el producto de acoplamiento cruzado mientras se regenera el catalizador de Pd(0) ( 1 ). [8] En los catalizadores de paladio, la adición oxidativa que a menudo determina la velocidad se produce más lentamente que en los sistemas catalíticos de níquel. [8]

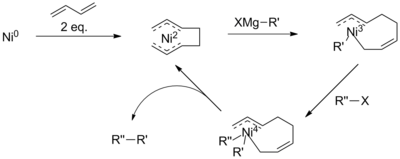
La comprensión actual del mecanismo del acoplamiento catalizado por níquel es limitada. De hecho, se cree que el mecanismo de reacción se produce de manera diferente en diferentes condiciones de reacción y cuando se utilizan diferentes ligandos de níquel. [9] En general, el mecanismo todavía puede describirse como análogo al esquema de paladio (derecha). Sin embargo, bajo ciertas condiciones de reacción, el mecanismo no logra explicar todas las observaciones. El examen realizado por Vicic y sus compañeros de trabajo utilizando ligando de terpiridina tridentado identificó intermediarios de un ciclo catalítico Ni (II) -Ni (I) -Ni (III), [10], lo que sugiere un esquema más complicado. Además, con la adición de butadieno, se cree que la reacción implica un intermedio de Ni(IV). [11]
El acoplamiento Kumada se ha demostrado con éxito para una variedad de haluros de arilo o vinilo. En lugar del reactivo de haluro, también se pueden utilizar pseudohaluros, y se ha demostrado que el acoplamiento es bastante eficaz utilizando especies de tosilato [12] y triflato [13] en diversas condiciones.
A pesar del amplio éxito con los acoplamientos de arilo y vinilo, el uso de haluros de alquilo es menos generalizado debido a varios factores que complican la situación. Al no tener electrones π, los haluros de alquilo requieren mecanismos de adición oxidativa diferentes a los de los grupos arilo o vinilo, y estos procesos actualmente no se conocen bien. [9] Además, la presencia de β-hidrógenos hace que los haluros de alquilo sean susceptibles a procesos de eliminación competitivos . [14]
Estos problemas se han solucionado gracias a la presencia de un grupo activador, como el carbonilo de las α-bromocetonas, que impulsa la reacción. Sin embargo, los acoplamientos de Kumada también se han realizado con cadenas alquílicas no activadas, a menudo mediante el uso de catalizadores o reactivos adicionales. Por ejemplo, con la adición de 1,3-butadienos, Kambe y sus compañeros demostraron acoplamientos alquil-alquilo catalizados por níquel que de otro modo no serían reactivos. [15]

Aunque no se comprende bien, se propone que el mecanismo de esta reacción implica la formación de un complejo de octadienil níquel. Se propone que este catalizador se someta primero a una transmetalación con un reactivo de Grignard, antes de la eliminación reductora del haluro, lo que reduce el riesgo de eliminación del β-hidruro. Sin embargo, la presencia de un intermedio de Ni (IV) es contraria a los mecanismos propuestos para los acoplamientos de haluro de arilo o vinilo. [11]
En las publicaciones originales de Kumada y Corriu se informaron acoplamientos que involucran reactivos de Grignard de arilo y vinilo. [2] Los reactivos de alquil Grignard también se pueden utilizar sin dificultad, ya que no sufren procesos de eliminación de β-hidruro. Aunque el reactivo de Grignard tiene inherentemente poca tolerancia a los grupos funcionales, se han preparado síntesis a baja temperatura con grupos arilo altamente funcionalizados. [dieciséis]
Los acoplamientos Kumada se pueden realizar con una variedad de catalizadores de níquel (II) o paladio (II). Las estructuras de los precursores catalíticos pueden formularse generalmente como ML 2 X 2 , donde L es un ligando de fosfina. [17] Las opciones comunes para L 2 incluyen ligandos de difosfina bidentados como dppe y dppp, entre otros.
El trabajo de Alois Fürstner y sus compañeros de trabajo sobre catalizadores a base de hierro ha mostrado rendimientos razonables. Se propone que la especie catalítica en estas reacciones sea un "reactivo de Grignard inorgánico" que consiste en Fe(MgX) 2 . [18]
La reacción normalmente se lleva a cabo en tetrahidrofurano o éter dietílico como disolvente. Dichos disolventes etéreos son convenientes porque son disolventes típicos para generar el reactivo de Grignard. [2] Debido a la alta reactividad del reactivo de Grignard, los acoplamientos de Kumada tienen una tolerancia limitada a los grupos funcionales, lo que puede resultar problemático en síntesis de gran tamaño. En particular, los reactivos de Grignard son sensibles a la protonólisis incluso de grupos ligeramente ácidos como los alcoholes . También se suman a carbonilos y otros grupos oxidativos.
Como en muchas reacciones de acoplamiento, el catalizador de paladio, metal de transición, suele ser sensible al aire y requiere un entorno de reacción inerte de argón o nitrógeno.
Una muestra de preparación sintética está disponible en el sitio web de Organic Syntheses .
Tanto los haluros de cis como trans olefina promueven la retención general de la configuración geométrica cuando se combinan con alquil Grignards. Esta observación es independiente de otros factores, incluida la elección de los ligandos del catalizador y los sustituyentes vinílicos. [17]
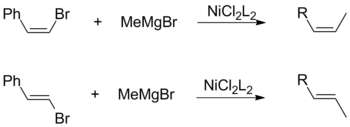
Por el contrario, un acoplamiento de Kumada que utiliza reactivos vinílicos de Grignard se produce sin estereoespecificidad para formar una mezcla de alquenos cis y trans . El grado de isomerización depende de una variedad de factores que incluyen las proporciones de los reactivos y la identidad del grupo haluro. Según Kumada, esta pérdida de estereoquímica es atribuible a reacciones secundarias entre dos equivalentes del reactivo alílico de Grignard. [17]


Los acoplamientos asimétricos de Kumada se pueden efectuar mediante el uso de ligandos quirales . Utilizando ligandos de ferroceno quirales planos , se han observado excesos enantioméricos (ee) superiores al 95% en acoplamientos de arilo. [19] Más recientemente, Gregory Fu y sus colaboradores han demostrado acoplamientos enantioconvergentes de α-bromocetonas utilizando catalizadores basados en ligandos de bis-oxazolina, en los que el catalizador quiral convierte una mezcla racémica de material de partida en un enantiómero de producto con hasta 95% de ee. [20] Esta última reacción también es importante porque implica un acoplamiento de haluro de alquilo tradicionalmente inaccesible.
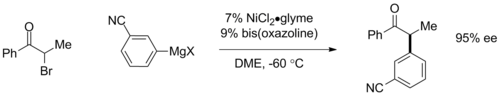
Los reactivos de Grignard no suelen acoplarse con arenos clorados. Esta baja reactividad es la base de la quimioselectividad para la inserción del níquel en el enlace C-Br del bromoclorobenceno utilizando un catalizador a base de NiCl 2 . [21]

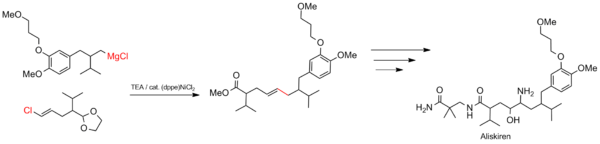
El acoplamiento Kumada es adecuado para procesos industriales a gran escala, como la síntesis de fármacos. La reacción se utiliza para construir el esqueleto carbonado del aliskiren (nombre comercial Tekturna), un tratamiento para la hipertensión . [22]
El acoplamiento de Kumada también es prometedor en la síntesis de polímeros conjugados , polímeros como los polialquiltiofenos (PAT), que tienen una variedad de aplicaciones potenciales en células solares orgánicas y diodos emisores de luz . [23] En 1992, McCollough y Lowe desarrollaron la primera síntesis de polialquiltiofenos regioregulares utilizando el esquema de acoplamiento de Kumada que se muestra a continuación, que requiere temperaturas bajo cero. [24]
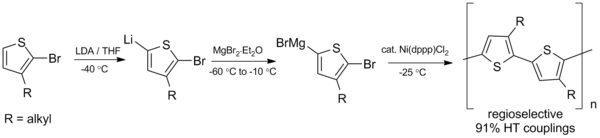
Desde esta preparación inicial, la síntesis se ha mejorado para obtener mayores rendimientos y operar a temperatura ambiente. [25]