La acetilacetona es un compuesto orgánico con la fórmula química CH 3 −C(=O)−CH 2 −C(=O)−CH 3 . Se clasifica como una 1,3- dicetona . Existe en equilibrio con un tautómero CH 3 −C(=O)−CH=C(−OH)−CH 3 . La mezcla es un líquido incoloro. Estos tautómeros se interconvierten tan rápidamente en la mayoría de las condiciones que se tratan como un solo compuesto en la mayoría de las aplicaciones. [2] La acetilacetona es un componente básico para la síntesis de muchos complejos de coordinación , así como compuestos heterocíclicos .
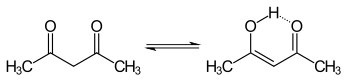
Los tautómeros ceto y enol de la acetilacetona coexisten en solución. La forma enol tiene simetría C 2v , lo que significa que el átomo de hidrógeno se comparte equitativamente entre los dos átomos de oxígeno. [4] En la fase gaseosa, la constante de equilibrio , K ceto→enol , es 11,7, lo que favorece la forma enol. Las dos formas tautoméricas se pueden distinguir mediante espectroscopia RMN , espectroscopia IR y otros métodos. [5] [6]
La constante de equilibrio tiende a ser alta en solventes no polares; cuando K ceto→enol es igual o mayor que 1, se favorece la forma enólica. La forma ceto se vuelve más favorable en solventes polares que forman enlaces de hidrógeno, como el agua. [7] La forma enólica es un análogo vinílico de un ácido carboxílico . [ cita requerida ]
La acetilacetona es un ácido débil . Forma el anión acetilacetonato C 5 H 7 O−2(comúnmente abreviado acac − ):

En el anión acetilacetonato, ambos enlaces C - O son equivalentes. Ambos enlaces centrales CC también son equivalentes, con un átomo de hidrógeno unido al átomo de carbono central (el átomo C3 ). Esas dos equivalencias se deben a que existe una resonancia entre los cuatro enlaces en el enlace O-C2-C3-C4-O en el anión acetilacetonato, donde el orden de enlace de esos cuatro enlaces es de aproximadamente 1,5. Ambos átomos de oxígeno comparten por igual la carga negativa . El anión acetilacetonato es un ligando bidentado .
Los valores de p K a recomendados por la IUPAC para este equilibrio en solución acuosa a 25 °C son 8,99 ± 0,04 ( I = 0), 8,83 ± 0,02 ( I = 0,1 M NaClO 4 ) y 9,00 ± 0,03 ( I = 1,0 M NaClO 4 ; I = Fuerza iónica ). [9] Hay valores disponibles para disolventes mixtos. Las bases muy fuertes , como los compuestos de organolitio , desprotonarán la acetilacetona dos veces. Las especies de dilitio resultantes pueden entonces ser alquiladas en el átomo de carbono en la posición 1 .
La acetilacetona se prepara industrialmente mediante la reorganización térmica del acetato de isopropenilo . [10]
Las rutas de laboratorio para la acetilacetona también comienzan con acetona . Acetona y anhídrido acético ( (CH 3 C(O)) 2 O ) tras la adición de catalizador de trifluoruro de boro ( BF 3 ): [11]
Una segunda síntesis implica la condensación catalizada por bases (por ejemplo, mediante etóxido de sodio CH 3 CH 2 O − Na + ) de acetona y acetato de etilo , seguida de la acidificación del acetilacetonato de sodio (por ejemplo, mediante cloruro de hidrógeno HCl): [11]
Debido a la facilidad de estas síntesis, se conocen muchos análogos de acetilacetonatos. Algunos ejemplos son la benzoilacetona , el dibenzoilmetano (dbaH) [ aclaración necesaria ] y el análogo de terc -butilo 2,2,6,6-tetrametil-3,5-heptanodiona. La trifluoroacetilacetona y el hexafluoroacetilacetonato también se utilizan para generar complejos metálicos volátiles .
La acetilacetona es un precursor bifuncional versátil de los heterociclos porque ambos grupos ceto pueden sufrir condensación . Por ejemplo, la condensación con hidracina produce pirazoles, mientras que la condensación con urea proporciona pirimidinas . La condensación con dos aril- o alquilaminas da NacNacs , donde los átomos de oxígeno en la acetilacetona se reemplazan por NR (R = arilo, alquilo).

El acetilacetonato de sodio , Na(acac), es el precursor de muchos complejos de acetilacetonato . Un método general de síntesis es tratar una sal metálica con acetilacetona en presencia de una base : [12]
Ambos átomos de oxígeno se unen al metal para formar un anillo quelante de seis miembros. En algunos casos, el efecto quelante es tan fuerte que no se necesita ninguna base añadida para formar el complejo.
La enzima acetilacetona dioxigenasa rompe el enlace carbono-carbono de la acetilacetona, produciendo acetato y 2-oxopropanal . La enzima depende del hierro(II) , pero se ha demostrado que también se une al zinc . La degradación de la acetilacetona se ha caracterizado en la bacteria Acinetobacter johnsonii . [13]