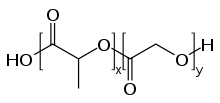
PLGA , PLG o ácido poli(láctico- co -glicólico) ( CAS : 26780-50-7) es un copolímero que se utiliza en una serie de dispositivos terapéuticos aprobados por la Administración de Alimentos y Medicamentos (FDA), debido a su biodegradabilidad y biocompatibilidad. . [1] El PLGA se sintetiza mediante copolimerización con apertura de anillo de dos monómeros diferentes , los dímeros cíclicos (1,4-dioxano-2,5-dionas) del ácido glicólico y del ácido láctico . Los polímeros se pueden sintetizar como copolímeros aleatorios o en bloque, impartiendo así propiedades poliméricas adicionales. Los catalizadores comunes utilizados en la preparación de este polímero incluyen 2-etilhexanoato de estaño (II) , alcóxidos de estaño (II) o isopropóxido de aluminio . Durante la polimerización, unidades monoméricas sucesivas (de ácido glicólico o láctico) se unen en PLGA mediante enlaces éster , produciendo así un poliéster alifático lineal como producto. [2]
Dependiendo de la proporción de lactida a glicolida utilizada para la polimerización, se pueden obtener diferentes formas de PLGA: normalmente se identifican con respecto a la proporción molar de los monómeros utilizados (por ejemplo, PLGA 75:25 identifica un copolímero cuya composición es 75% de láctico). ácido y 25% de ácido glicólico). La cristalinidad de los PLGA variará desde completamente amorfo hasta completamente cristalino dependiendo de la estructura del bloque y la relación molar. Los PLGA suelen mostrar una temperatura de transición vítrea en el rango de 40 a 60 °C. El PLGA se puede disolver con una amplia gama de disolventes , según su composición. Los polímeros con mayor contenido de lactida se pueden disolver utilizando disolventes clorados , mientras que los materiales con mayor contenido de glicolida requerirán el uso de disolventes fluorados como el HFIP .
El PLGA se degrada por hidrólisis de sus enlaces éster en presencia de agua . Se ha demostrado que el tiempo necesario para la degradación del PLGA está relacionado con la proporción de monómeros utilizados en la producción: cuanto mayor es el contenido de unidades de glicolida, menor es el tiempo necesario para la degradación en comparación con los materiales predominantemente lactidos. Una excepción a esta regla es el copolímero con una proporción de monómeros de 50:50 que presenta una degradación más rápida (aproximadamente dos meses). Además, los polímeros cuyos extremos están protegidos con ésteres (a diferencia del ácido carboxílico libre ) demuestran vidas medias de degradación más largas. [3] Esta flexibilidad en la degradación lo ha hecho conveniente para la fabricación de muchos dispositivos médicos , como injertos , suturas , implantes , dispositivos protésicos , películas selladoras quirúrgicas, micro y nanopartículas . [4]
El PLGA sufre hidrólisis en el cuerpo para producir los monómeros originales: ácido láctico y ácido glicólico. Estos dos monómeros, en condiciones fisiológicas normales, son subproductos de diversas vías metabólicas en el cuerpo. El ácido láctico se metaboliza en el ciclo del ácido tricarboxílico y se elimina mediante dióxido de carbono y agua . El ácido glicólico se metaboliza de la misma forma y también se excreta a través del riñón. [5] El cuerpo también puede metabolizar los dos monómeros, que en el caso del ácido glicólico produce pequeñas cantidades del tóxico ácido oxálico , aunque las cantidades producidas en aplicaciones típicas son minúsculas y existe una toxicidad sistémica mínima asociada con el uso de PLGA para aplicaciones de biomateriales. . Sin embargo, se ha informado que la degradación ácida del PLGA reduce el pH local lo suficiente como para crear un ambiente autocatalítico . [6] Se ha demostrado que el pH dentro de una microesfera puede volverse tan ácido como pH 1,5. [7]
Generalmente se considera que el PLGA es bastante biocompatible. Su alta biocompatibilidad se debe a su composición debido a la fermentación del ácido láctico y glicólico de los azúcares, haciéndolos ecológicos y menos reactivos en el organismo. [8] El PLGA también se degrada en productos no tóxicos y no reactivos, lo que los hace bastante útiles para diversas aplicaciones médicas y farmacéuticas.
La biocompatibilidad del PLGA ha sido probada tanto in vivo como in vitro. [9] La biocompatibilidad de este polímero generalmente está determinada por los productos en los que se degrada, así como por la tasa de degradación en productos de degradación. La forma en que se degrada el PLGA es mediante una enzima conocida como esterasa , que forma ácido láctico y ácido glicólico. Estos ácidos luego pasan por el ciclo de Krebs para degradarse como dióxido de carbono (CO 2 ) y agua ( H 2 O ). [10] Estos subproductos luego se eliminan del cuerpo a través de la respiración celular y del proceso digestivo.
Si bien los subproductos generalmente no se acumulan en el cuerpo, hay casos en los que estos subproductos (ácido láctico y glicólico) pueden ser peligrosos para el cuerpo cuando se acumulan en altas concentraciones locales. [11] También puede haber pequeños trozos de polímeros a medida que el polímero se degrada, provocando una respuesta inmune por parte de los macrófagos . Estos efectos adversos se pueden reducir utilizando concentraciones más bajas del polímero, de modo que se libere naturalmente en todo el cuerpo.
Otra cosa a considerar con respecto a la biocompatibilidad con PLGA es el lugar en el que se implanta o coloca el polímero en el cuerpo. Existen diferentes respuestas inmunes que el cuerpo podría tener dependiendo de dónde se coloque el polímero. Por ejemplo, en los sistemas de administración de fármacos (DDS), los implantes de PLGA y PLA con una gran superficie y un bajo volumen de inyección pueden aumentar las posibilidades de respuesta inmune a medida que los polímeros se degradan en el cuerpo.
La biodegradación del PLGA lo hace útil para muchas prácticas médicas. El PLGA sufre una degradación masiva, que ocurre cuando un catalizador como el agua se inserta en toda la matriz del polímero. [12] Se puede fabricar una proporción de PLGA de lactida a glicolida de 75:25 como microesferas que se degradan mediante erosión masiva. [12] Esto permite que la degradación en todo el polímero se produzca por igual.
Se desarrolló otra forma inyectable de PLGA para tener sistemas de erosión. Este formulario se puede utilizar en Lupron Depot . Para lograr esto, el PLGA se mezcla con un solvente orgánico miscible en agua aprobado por la Administración de Alimentos y Medicamentos (FDA). Una vez que el PLGA se mezcla con el solvente con el medicamento de elección para crear una solución o suspensión homogénea. Cuando se inyecta esta mezcla, el PLGA se solidifica debido a la insolubilidad en agua y es reemplazado por el agua. Lentamente, el fármaco sale de la solución. Un problema que puede ocurrir es que durante la inyección inicial, el medicamento puede liberarse rápidamente en lugar de gradualmente. [12]
Ejemplos específicos del uso de PLGA incluyen: