La hepatotoxicidad (de toxicidad hepática ) implica daño hepático provocado por sustancias químicas . La lesión hepática inducida por fármacos (DILI) es una causa de enfermedad hepática aguda y crónica causada específicamente por medicamentos y la razón más común por la que un fármaco se retira del mercado después de su aprobación.
El hígado desempeña un papel central en la transformación y limpieza de sustancias químicas y es susceptible a la toxicidad de estos agentes. Ciertos agentes medicinales, cuando se toman en sobredosis (por ejemplo, acetaminofeno, paracetamol ) y, a veces, incluso cuando se introducen dentro de los rangos terapéuticos (por ejemplo, halotano ), pueden dañar el órgano. Otros agentes químicos, como los utilizados en laboratorios e industrias, los productos químicos naturales (por ejemplo, alfa-amanitina ) y los remedios herbales (dos ejemplos destacados son la kava , aunque se desconoce el mecanismo causal, y la consuelda , a través del contenido de alcaloides de pirrolizidina) también pueden inducir hepatotoxicidad. Las sustancias químicas que causan daño hepático se denominan hepatotoxinas .
Más de 900 fármacos han sido implicados en causar daño hepático [1] (ver LiverTox, enlace externo, a continuación) y es la razón más común para que un fármaco sea retirado del mercado. La hepatotoxicidad y el daño hepático inducido por fármacos también representan un número sustancial de fracasos de compuestos, destacando la necesidad de modelos de predicción de toxicidad (por ejemplo, DTI), [2] y ensayos de detección de fármacos, como células similares a hepatocitos derivadas de células madre , que son capaces de detectar la toxicidad temprano en el proceso de desarrollo del fármaco . [3] Los productos químicos a menudo causan daño subclínico al hígado, que se manifiesta solo como pruebas de enzimas hepáticas anormales .
La lesión hepática inducida por fármacos es responsable del 5% de todas las admisiones hospitalarias y del 50% de todas las insuficiencias hepáticas agudas . [4] [5]
Las reacciones adversas a medicamentos se clasifican como tipo A (intrínsecas o farmacológicas) o tipo B (idiosincrásicas). [6] La reacción a medicamentos de tipo A representa el 80% de todas las toxicidades. [7]
Los fármacos o toxinas que tienen una hepatotoxicidad farmacológica (tipo A) son aquellos que tienen curvas de dosis-respuesta predecibles (concentraciones más altas causan más daño hepático) y mecanismos de toxicidad bien caracterizados, como dañar directamente el tejido hepático o bloquear un proceso metabólico. Como en el caso de la sobredosis de paracetamol , este tipo de lesión ocurre poco después de que se alcanza un cierto umbral de toxicidad. El tetracloruro de carbono se utiliza comúnmente para inducir una lesión hepática aguda de tipo A en modelos animales.
La lesión idiosincrásica (tipo B) ocurre sin previo aviso, cuando los agentes causan una hepatotoxicidad no predecible en individuos susceptibles, que no está relacionada con la dosis y tiene un período de latencia variable. [8] Este tipo de lesión no tiene una relación dosis-respuesta clara ni temporal, y la mayoría de las veces no tiene modelos predictivos. La hepatotoxicidad idiosincrásica ha llevado al retiro de varios medicamentos del mercado incluso después de rigurosas pruebas clínicas como parte del proceso de aprobación de la FDA; Troglitazona (Rezulin) [2] [9] y trovafloxacina (Trovan) son dos ejemplos principales de hepatotoxinas idiosincrásicas retiradas del mercado.
La hierba kava ha causado numerosos casos de lesiones hepáticas idiosincrásicas, desde asintomáticas hasta fatales.
El uso oral del antimicótico ketoconazol se ha asociado con toxicidad hepática, incluidas algunas muertes; [10] sin embargo, dichos efectos parecen estar limitados a dosis tomadas durante un período superior a 7 días. [11]
El paracetamol , también conocido como acetaminofeno y con las marcas comerciales Tylenol y Panadol, suele tolerarse bien en la dosis prescrita, pero la sobredosis es la causa más común de enfermedad hepática inducida por fármacos e insuficiencia hepática aguda en todo el mundo. [12] El daño al hígado no se debe al fármaco en sí, sino a un metabolito tóxico ( N -acetil- p -benzoquinona imina (NAPQI)) producido por las enzimas del citocromo P-450 en el hígado. [13] En circunstancias normales, este metabolito se desintoxica conjugándose con glutatión en la reacción de fase 2. En una sobredosis, se genera una gran cantidad de NAPQI, que abruma el proceso de desintoxicación y conduce al daño de las células hepáticas. El óxido nítrico también juega un papel en la inducción de toxicidad. [14] El riesgo de lesión hepática está influenciado por varios factores, incluyendo la dosis ingerida, la ingesta concurrente de alcohol u otras drogas, el intervalo entre la ingestión y el antídoto, etc. La dosis tóxica para el hígado es bastante variable de persona a persona y a menudo se piensa que es menor en alcohólicos crónicos. [15] [16] La medición del nivel en sangre es importante para evaluar el pronóstico, los niveles más altos predicen un peor pronóstico. La administración de acetilcisteína , un precursor del glutatión, puede limitar la gravedad del daño hepático al capturar el NAPQI tóxico. Aquellos que desarrollan insuficiencia hepática aguda aún pueden recuperarse espontáneamente, pero pueden requerir trasplante si hay signos de mal pronóstico como encefalopatía o coagulopatía (ver Criterios del King's College ). [17]
Aunque los analgésicos individuales rara vez inducen daño hepático debido a su uso generalizado, los AINE han surgido como un grupo importante de medicamentos que presentan hepatotoxicidad. Se han documentado reacciones tanto dependientes de la dosis como idiosincrásicas. [18] La aspirina y la fenilbutazona se asocian con hepatotoxicidad intrínseca; la reacción idiosincrásica se ha asociado con ibuprofeno, sulindac, fenilbutazona, piroxicam, diclofenac e indometacina.
Los glucocorticoides se denominan así debido a su efecto sobre el mecanismo de los carbohidratos. Promueven el almacenamiento de glucógeno en el hígado. El agrandamiento del hígado es un efecto secundario poco frecuente del uso prolongado de esteroides en niños. [19] El efecto clásico del uso prolongado tanto en la población adulta como en la pediátrica es la esteatosis . [20]
La isoniazida (INH) es uno de los medicamentos más utilizados para la tuberculosis ; se asocia con una elevación leve de las enzimas hepáticas en hasta el 20% de los pacientes y una hepatotoxicidad grave en el 1-2% de los pacientes. [21]
También hay casos en los que otros fármacos derivados de la hidrazina , como el antidepresivo IMAO iproniazida , se asocian con daño hepático. [22] [23] La fenelzina se ha asociado con pruebas hepáticas anormales. [24] Los antibióticos pueden producir efectos tóxicos. [25]

Entre los ejemplos se incluyen los hongos que contienen alfa-amanitina , la kava y los mohos productores de aflatoxina. Los alcaloides de pirrolizidina , que se encuentran en algunas plantas, pueden ser tóxicos. [26] [27] El extracto de té verde es una causa creciente de insuficiencia hepática debido a su inclusión en más productos. [28] [29] [30]
Los ejemplos incluyen: fruta de ackee , bajiaolian , alcanfor , copaltra, cicasina , garcinia , [31] hojas de kava , alcaloides de pirrolizidina , hojas de castaño de indias , valeriana , consuelda . [32] [33] Remedios herbales chinos: Jin Bu Huan, efedra , Shou Wu Pian , Bai Xian Pi . [34] [35]
Los ejemplos incluyen arsénico , tetracloruro de carbono y cloruro de vinilo . [36]
Los medicamentos siguen siendo retirados del mercado debido al descubrimiento tardío de la hepatotoxicidad. Debido a su metabolismo único y su estrecha relación con el tracto gastrointestinal , el hígado es susceptible a lesiones causadas por medicamentos y otras sustancias. El 75% de la sangre que llega al hígado llega directamente de los órganos gastrointestinales y el bazo a través de las venas porta que llevan medicamentos y xenobióticos en forma casi pura. Varios mecanismos son responsables de inducir la lesión hepática o empeorar el proceso de daño.
Muchos productos químicos dañan las mitocondrias , un orgánulo intracelular que produce energía. Su disfunción libera una cantidad excesiva de oxidantes que, a su vez, dañan las células hepáticas. La activación de algunas enzimas en el sistema del citocromo P-450, como CYP2E1, también conduce al estrés oxidativo. [37] La lesión de los hepatocitos y las células de los conductos biliares conduce a la acumulación de ácido biliar dentro del hígado . Esto promueve un mayor daño hepático. [38] Las células no parenquimatosas como las células de Kupffer , las células estrelladas productoras de colágeno y los leucocitos (es decir, los neutrófilos y los monocitos ) también tienen un papel en el mecanismo.
El cuerpo humano somete la mayoría de los compuestos, pero no todos, a varios procesos químicos (es decir, metabolismo ) para hacerlos aptos para su eliminación. Esto implica transformaciones químicas para (a) reducir la solubilidad en grasas y (b) cambiar la actividad biológica. Aunque casi todos los tejidos del cuerpo tienen cierta capacidad para metabolizar sustancias químicas, el retículo endoplasmático liso del hígado es el principal "centro de compensación metabólico" tanto para sustancias químicas endógenas (p. ej., colesterol , hormonas esteroides, ácidos grasos , proteínas ) como para sustancias exógenas (p. ej., fármacos, alcohol). [39] El papel central que desempeña el hígado en la depuración y transformación de sustancias químicas lo hace susceptible a las lesiones inducidas por fármacos.
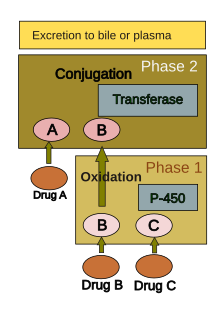
El metabolismo de los fármacos se divide generalmente en dos fases: fase 1 y fase 2. La reacción de la fase 1 se utiliza generalmente para preparar un fármaco para la fase 2. Sin embargo, muchos compuestos pueden metabolizarse directamente en la fase 2 o excretarse sin que se produzca ninguna reacción de la fase 2. La reacción de la fase 1 implica oxidación , reducción , hidrólisis , hidratación y muchas otras reacciones químicas poco frecuentes. Estos procesos tienden a aumentar la solubilidad en agua del fármaco y pueden generar metabolitos que son más activos químicamente y/o potencialmente tóxicos. La mayoría de las reacciones de la fase 2 tienen lugar en el citosol e implican la conjugación con compuestos endógenos a través de enzimas transferasas . La fase 1 suele ser más adecuada para la eliminación.
Un grupo de enzimas ubicadas en el retículo endoplasmático, conocido como citocromo P-450 , es la familia más importante de enzimas metabolizadoras en el hígado. El citocromo P-450 no es una enzima única, sino que consiste en una familia estrechamente relacionada de 50 isoformas ; seis de ellas metabolizan el 90% de los fármacos. [40] [41] Existe una tremenda diversidad de productos génicos individuales del P-450, y esta heterogeneidad permite al hígado realizar la oxidación de una amplia gama de sustancias químicas (incluida la mayoría de los fármacos) en la fase 1. Tres características importantes del sistema P-450 tienen funciones en la toxicidad inducida por fármacos:
Cada una de las proteínas P-450 es única y explica (en cierta medida) la variación en el metabolismo de los fármacos entre individuos. Las variaciones genéticas ( polimorfismo ) en el metabolismo de P-450 deben tenerse en cuenta cuando los pacientes muestran una sensibilidad o resistencia inusual a los efectos de los fármacos en dosis normales. Dicho polimorfismo también es responsable de la respuesta variable a los fármacos entre pacientes de diferentes orígenes étnicos.
Muchas sustancias pueden influir en el mecanismo de la enzima P-450. Los fármacos interactúan con la familia de enzimas de varias maneras. [44] Los fármacos que modifican la enzima citocromo P-450 se denominan inhibidores o inductores. Los inhibidores de enzimas bloquean la actividad metabólica de una o varias enzimas P-450. Este efecto suele ocurrir de inmediato. Por otro lado, los inductores aumentan la actividad de P-450 al aumentar la producción de enzimas o, en el caso de CYP2E1, al prevenir la degradación en el proteasoma . Suele haber un retraso antes de que aumente la actividad enzimática. [41]
Algunos fármacos pueden compartir la misma especificidad de P-450 y, por lo tanto, bloquear competitivamente su biotransformación. Esto puede provocar la acumulación de fármacos metabolizados por la enzima. Este tipo de interacción farmacológica también puede reducir la tasa de generación de metabolitos tóxicos.
Los productos químicos producen una amplia variedad de lesiones hepáticas clínicas y patológicas . Los marcadores bioquímicos (por ejemplo, alanina transferasa , fosfatasa alcalina y bilirrubina ) se utilizan a menudo para indicar daño hepático. La lesión hepática se define como un aumento en (a) el nivel de ALT más de tres veces el límite superior de lo normal (LSN), (b) el nivel de ALP más del doble del LSN, o (c) el nivel de bilirrubina total más del doble del LSN cuando se asocia con un aumento de ALT o ALP. [45] [46] El daño hepático se caracteriza además en tipos hepatocelular (elevación predominantemente inicial de alanina transferasa ) y colestásico (elevación inicial de fosfatasa alcalina). Sin embargo, no son mutuamente excluyentes y a menudo se encuentran tipos mixtos de lesiones.
A continuación se analizan los patrones histopatológicos específicos de lesión hepática causada por daño inducido por fármacos.
Este es el tipo más común de necrosis de células hepáticas inducida por fármacos, en la que la lesión se limita en gran medida a una zona particular del lóbulo hepático . Puede manifestarse como un nivel muy alto de ALT y una alteración grave de la función hepática que conduce a una insuficiencia hepática aguda .
En este patrón, la necrosis hepatocelular se asocia con la infiltración de células inflamatorias. Puede haber tres tipos de hepatitis inducida por fármacos. (A) La hepatitis viral es la más común, donde las características histológicas son similares a la hepatitis viral aguda. (B) En la hepatitis focal o no específica, los focos dispersos de necrosis celular pueden acompañar a la infiltración linfocítica . (C) La hepatitis crónica es muy similar a la hepatitis autoinmune clínica, serológica e histológicamente.
La lesión hepática produce alteración del flujo biliar y predominan los casos de prurito e ictericia. La histología puede mostrar inflamación (hepatitis colestásica) o puede ser blanda (sin inflamación parenquimatosa ). En raras ocasiones, puede producir características similares a la cirrosis biliar primaria debido a la destrucción progresiva de los conductos biliares pequeños ( síndrome del conducto evanescente ).
La hepatotoxicidad puede manifestarse como acumulación de triglicéridos, lo que conduce a un hígado graso en gotas pequeñas (microvesicular) o en gotas grandes (macrovesicular). Existe un tipo de esteatosis independiente en el que la acumulación de fosfolípidos conduce a un patrón similar a las enfermedades con defectos hereditarios del metabolismo de los fosfolípidos (p. ej., enfermedad de Tay-Sachs ).
Los granulomas hepáticos inducidos por fármacos suelen estar asociados a granulomas en otros tejidos y los pacientes suelen presentar características de vasculitis sistémica e hipersensibilidad. Se han implicado más de 50 fármacos.
Estos son resultado de una lesión en el endotelio vascular.
Se han descrito neoplasias con la exposición prolongada a algunos medicamentos o toxinas. El carcinoma hepatocelular, el angiosarcoma y los adenomas hepáticos son los más reportados.

Esto sigue siendo un desafío en la práctica clínica debido a la falta de marcadores confiables. [47] Muchas otras condiciones conducen a cuadros clínicos y patológicos similares. Para diagnosticar la hepatotoxicidad, se debe establecer una relación causal entre el uso de la toxina o el fármaco y el daño hepático posterior, pero puede ser difícil, especialmente cuando se sospecha una reacción idiosincrásica. [48] El uso simultáneo de múltiples fármacos puede agregar complejidad. Al igual que en la toxicidad del paracetamol, la hepatotoxicidad farmacológica dependiente de la dosis bien establecida es más fácil de detectar. Se han propuesto varias escalas clínicas, como la escala CIOMS /RUCAM y los criterios de Maria y Victorino, para establecer una relación causal entre el fármaco agresor y el daño hepático. La escala CIOMS/RUCAM implica un sistema de puntuación que clasifica la sospecha en “definitiva o muy probable” (puntuación > 8), “probable” (puntuación 6-8), “posible” (puntuación 3-5), “improbable” (puntuación 1-2) y “excluida” (puntuación ≤ 0). En la práctica clínica, los médicos ponen más énfasis en la presencia o ausencia de similitud entre el perfil bioquímico del paciente y el perfil bioquímico conocido de la toxicidad sospechada (p. ej., daño colestásico en amoxicilina-ácido clauvónico ). [47]
En la mayoría de los casos, la función hepática se normaliza si se suspende el fármaco causante de forma temprana. Además, el paciente puede requerir tratamiento de apoyo. Sin embargo, en caso de intoxicación por paracetamol , la agresión inicial puede ser mortal. La insuficiencia hepática fulminante por hepatotoxicidad inducida por fármacos puede requerir un trasplante de hígado. En el pasado, se habían utilizado glucocorticoides en casos de alergia y ácido ursodesoxicólico en casos de colestasia, pero no hay pruebas sólidas que respalden su eficacia. [ cita requerida ]
Una elevación del nivel de bilirrubina sérica de más de 2 veces el LSN con aumento asociado de las transaminasas es un signo ominoso. Esto indica hepatotoxicidad grave y es probable que conduzca a la mortalidad en el 10% al 15% de los pacientes, especialmente si no se suspende el fármaco causante ( Ley de Hy ). [49] [50] Esto se debe a que se requiere un daño significativo al hígado para afectar la excreción de bilirrubina, por lo tanto, un deterioro menor (en ausencia de obstrucción biliar o síndrome de Gilbert ) no conduciría a ictericia. Otros malos predictores del resultado son la edad avanzada, el sexo femenino y la AST alta . [51] [52]
Los siguientes medicamentos terapéuticos fueron retirados del mercado principalmente debido a hepatotoxicidad: troglitazona , bromfenaco , trovafloxacino , ebrotidina , nimesulida , nefazodona , ximelagatrán y pemolina . [47] [53] [54]