El dominio efector de muerte ( DED ) es un dominio de interacción de proteínas que se encuentra sólo en eucariotas y que regula una variedad de vías de señalización celular. [2] El dominio DED se encuentra en procaspasas inactivas ( cisteína proteasas ) y proteínas que regulan la activación de caspasas en la cascada de apoptosis, como la proteína que contiene el dominio de muerte asociada a FAS ( FADD ). FADD recluta procaspasa 8 y procaspasa 10 en un complejo de señalización inducida por muerte (DISC). Este reclutamiento está mediado por una interacción homotípica entre la procaspasa DED y una segunda DED que es un dominio efector de muerte en una proteína adaptadora que está directamente asociada con los receptores de TNF activados. La formación de complejos permite la activación proteolítica de la procaspasa en la forma de caspasa activa, lo que da como resultado el inicio de la apoptosis (muerte celular). Estructuralmente, el dominio DED es una subclase de motivo proteico conocido como pliegue de la muerte y contiene 6 hélices alfa, que se parecen mucho a la estructura del dominio de la muerte (DD).

DED es una subfamilia de la superfamilia DD (otros dominios reconocibles en esta superfamilia son: dominio de reclutamiento de caspasas (CARD) , dominio de pirina (PYD) y dominio de muerte (DD)). Las subfamilias se parecen estructuralmente entre sí, todas ellas (y DED en particular) están compuestas por un haz de 6 hélices alfa, pero divergen en las características de la superficie.
La estructura primaria completa de este dominio proteico no se ha definido de forma consensuada. Algunos estudios describieron los residuos 2-184, pero los residuos C-terminal y N-terminal aún no se han identificado. La presencia de aminoácidos que determinan la solubilidad y agregación a DED permitió identificar DED's en diferentes proteínas, como caspasa-8 y MC159. La estructura secundaria del dominio, como ya se ha dicho, está formada por 6 hélices alfa.
La estructura terciaria del dominio ha sido descrita a partir de la cristalización de caspasa 8 en el ser humano. El método utilizado para describir la estructura fue la difracción de RAYOS X y la resolución obtenida es de 2,2 Å. [3] Los DED en esta proteína muestran una unidad de dímero asimétrica , cuya interfaz contiene dos redes de enlaces de hidrógeno, que aparecen como una estructura filamentosa. La función del DED está determinada por su estructura. Hasta donde se sabe, las interacciones homotípicas que activan la caspasa y desencadenan la apoptosis están mediadas por contactos superficiales asimétricos entre parejas (como DED1 y DED2 en el caso de caspasa-8). [4] Los residuos que forman las superficies suelen ser aminoácidos cargados, pero también se puede observar un parche hidrofóbico corto en la superficie interactiva del dominio.
El dominio DED es mejor conocido por su papel en la apoptosis. Sin embargo, las proteínas que contienen DED también participan en otros procesos celulares, de modo que controlan las decisiones tanto de vida como de muerte de las células.
[5] La apoptosis es una muerte celular controlada y programada que confiere ventajas durante el ciclo de vida de un organismo. La vía extrínseca está dirigida por una familia de proteasas que se activan en respuesta a estímulos de muerte. Para conocer el papel de las EOS en este proceso es importante observar la formación del complejo multiproteico de señalización que incluye la muerte (DISC).
DR4 , TRAIL-R2 y CD95 son receptores de muerte (miembros de la superfamilia de receptores de TNF ) que interactúan entre sí utilizando sus dominios de muerte intracelulares (DD). El DD de FADD, una proteína que contiene una DED, puede entonces interactuar con estos DD descritos. Aquí la función de FADD DED es crear una estructura estabilizada mediante la autoasociación de FADD.

[6] Estas interacciones están definidas por las hélices α1/α4 y α2/α3: los residuos Ser1, Val6, His9, Leu43, Asp44 y Glu51 de α1/α4 están en contacto con Thr21, Phe25, Lys33, Arg34, Glu37 y Glu51 de α2. /α3 de la segunda molécula. Cada interacción implica un área de 1062 Å 2 y contribuciones de cadenas laterales hidrofóbicas, enlaces de hidrógeno y puentes salinos. El homodímero final tiene una estructura orientada de modo que cada subunidad tenga los 2 sitios de interacción.
La procaspasa-8, también una proteína que contiene DED, tiene afinidad por FADD DED. Es por esa razón que FADD los recluta como monómeros a través de sus DED. Esta interacción se define por α1/α4 de procapase-8 DED-A y FADD DED α2/α3 o α1/α4 de FADD DED y α2/α5 de procapase-8 DED-B. La procaspasa-8 DED-B interactúa con FADD y DED-A media la formación de la cadena capasa-8, o viceversa. Sin embargo, en ambos casos la interacción lleva a crear un dímero entre procaspasas, lo que genera un cambio conformacional. Esta dimerización es esencial para crear el sitio activo; Se libera una subunidad p12 y posteriormente se procesa en la subunidad pequeña p10. Las dos moléculas de procapasa-8 están asociadas con estas subunidades p10 creando una muerte celular activa de proteasa-8. [7] [8]
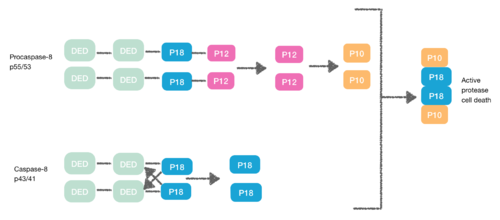
[9] Durante la creación del DISC, la procaspasa-8 también puede heterodimerizarse con otra proteína que contiene DED conocida como FLIP L. La pseudocaspasa de FLIP L tiene dos DED en tándem que son muy similares al extremo N de la capasa-8, pero en los que hay una mutación importante en el sitio activo (cisteína a tirosina).
Esta heterodimeración realizada entre sus DED impide la homodimeración normal por lo que la pseudocaspasa es incapaz de activar la cascada apoptótica. La pseudocaspasa de FLIP L es más eficaz para inducir el cambio conformacional. Sin embargo, FLIP L no tiene suficiente actividad enzimática, por lo que la escisión entre DED y p18 no es posible. En consecuencia, es imposible crear la muerte celular por proteasa activa. [10]
La procaspasa-8 también puede heterodimerizarse con FLIP S , también una proteína que contiene DED. En este caso, la heterodimerización directamente no logra activar la procaspasa-8 ya que el cambio conformacional inicial no puede tener lugar en el dominio caspasa de la procaspasa-8. [10]

Así es como la EOS también puede inhibir la cascada de apoptosis y la consecuencia es la necroptosis .
[11] Las caspasas son cisteína proteasas responsables del desmantelamiento de la célula durante la apoptosis .
Estas proteínas son zimógenos y se vuelven activas después de su escisión en sitios específicos dentro de la molécula.
Estructura:
Hay dos grupos de proteasas :
Los dos DED en tándem en el prodominio de caspasa inducen interacciones proteína-proteína con otras proteínas como FADD .
El estudio de las caspasas es importante ya que no sólo controlan la apoptosis sino que también la inhiben, dependiendo de la necesidad de la célula. Los científicos descubren que son un mecanismo que puede regular la vida celular y es importante para las terapias contra el cáncer.
Las proteínas inhibidoras tipo FLICE (FLIP) son inhibidores celulares capaces de detener la señal de los receptores de muerte, que provocan la apoptosis celular.
Los primeros FLIP que se identificaron fueron expresados por virus γ-herpes, por lo que se denominaron v-FLIP. Estos v-FLIP lograron asociarse con el receptor del complejo de señalización inductor de muerte (DISC) , bloqueando así la apoptosis mediada por CD95.
[12] Los vFLIP contienen predominantemente dos DED secuenciales, que son altamente homólogos al extremo N de la caspasa-8.
[10] Los homólogos celulares de v-FLIP generalmente se expresan de dos formas:
[12] Ambas formas de c-FLIP están redactadas en el CD95 DISC, donde se heterodimerizan con caspasa-8. c-FLIP ha estado involucrado en la señalización de vías alternativas, conectando el receptor CD95 con las vías NF-κB , JNK y MAPK .
PEA-15 (Fosfoproteína enriquecida en astrocitos-15 kDa) también conocida como PED (Fosfoproteína enriquecida en diabetes) es una proteína que contiene EOS con efectos pleiotrópicos .
PED es una proteína pequeña, no catalítica, que consta de un dominio efector de muerte (DED) N-terminal y una cola C-terminal con estructura irregular. [13] PED/PEA-15 interactúa con varios tipos de proteínas con y sin DED, y su especificidad de unirse a estas proteínas está mediada por la fosforilación de dos residuos de serina en la cola C-terminal:
[13] PEA-15 funciona como una proteína antiapoptótica DED en varias cascadas de señalización . En las vías mediadas por TNF α, CD95 y TRAIL, PEA-15 actúa uniendo e interrumpiendo las interacciones FADD y caspasa-8.
[10] Además de la apoptosis, PEA-15 inhibe el transporte de glucosa mediado por insulina en las células musculares, por lo que un alto nivel de expresión del ARNm de PEA-15 se ha asociado con la diabetes mellitus tipo II .
Dominio efector de muerte que contiene unión al ADN (DEDD). Muestra capacidad de unión al ADN, localizada en los nucléolos en sobreexpresión donde se asocia con una molécula llamada DEDAF (factor asociado a DED) que potencia la apoptosis. Además bloquea la transcripción de la ARN polimerasa I uniéndose al ADN.
DEDD2 (FLAME-3) es un homólogo de DEDD que comparte un 48,5% de la secuencia de aminoácidos. Se observa que interactúa con c-FLIP y DEDD y que tiene un papel importante en la represión de la transcripción dependiente de la polimerasa II .
La proteína 1 que interactúa con la Huntingtina (HIP-1) es una proteína que interactúa con la Huntingtina (Htt) , otra proteína que cuando muta (con repeticiones de poliglutamina expandida) forma agregados de proteínas en el cerebro de pacientes con enfermedad de Huntington (EH) .
[14] HIP-1 contiene un pseudo dominio efector de muerte (pDED) , es por eso que la sobreexpresión de HIP-1 induce apoptosis en varias células como lo hacen las proteínas DED. Este tipo de apoptosis depende de la pDED de HIP-1, y consiste en la activación de caspasa-3, una enzima que se reduce cuando se expresa Htt de tipo salvaje, lo que sugiere que HIP-1 coopera con Htt en la Mecanismo patogénico de la enfermedad de Huntington.
[10] Mediante la detección de dos híbridos de levadura , se ha demostrado que HIP-1 interactúa con una proteína de 419 aminoácidos llamada HIPPI (interactor de proteínas HIP-1). Experimentos posteriores han revelado que la presencia de HIPPI determina la apoptosis inducida por HIP-1 .
Proteína enorme asociada a FLICE. Contiene un dominio similar a DED, pero la homología es muy débil y su función aún no está clara.
[7] Se ha demostrado que los complejos DED funcionan en pasos cruciales que controlan los procesos de vida y muerte de las células. Este conocimiento es particularmente útil en terapia porque existen muchas patologías relacionadas con un control anormal de la vida celular.
La ausencia de apoptosis es una característica del cáncer. En algunos casos el gen que codifica la procaspasa-8 es silenciado por metilación, por lo que es necesario activar el gen mediante tratamientos epigenéticos para tener la proteasa activa. En otros casos existe una sobreexpresión de FLIP, la molécula antiapoptótica que impide la formación de la caspasa activa. En este caso, existen algunos agentes anticancerígenos que regulan negativamente la expresión de FLIP.
Sin embargo, la apoptosis anormal no es exclusiva del cáncer, existen otras patologías como la inflamación y enfermedades neurodegenerativas que también pueden tratarse con este tipo de terapéutica.