Las dioxigenasas son enzimas oxidorreductasas . La vida aeróbica , desde simples especies de bacterias unicelulares hasta complejos organismos eucariotas , ha evolucionado para depender del poder oxidante del dioxígeno en diversas vías metabólicas. Desde la generación energética de trifosfato de adenosina (ATP) hasta la degradación xenobiótica , el uso de dioxígeno como oxidante biológico está muy extendido y varía en el mecanismo exacto de su uso. Las enzimas emplean muchos esquemas diferentes para utilizar dioxígeno, y esto depende en gran medida del sustrato y de la reacción en cuestión.
En las monooxigenasas , solo un átomo de dioxígeno se incorpora a un sustrato y el otro se reduce a una molécula de agua. Las dioxigenasas ( EC 1.13.11) catalizan la oxidación de un sustrato sin la reducción de un átomo de oxígeno de dioxígeno a una molécula de agua. Sin embargo, esta definición es ambigua porque no tiene en cuenta cuántos sustratos están involucrados en la reacción. La mayoría de las dioxigenasas incorporan completamente dioxígeno en un único sustrato y se utilizan diversos esquemas de cofactores para lograrlo. Por ejemplo, en las enzimas dependientes de α-cetoglutarato , un átomo de dioxígeno se incorpora a dos sustratos, siendo siempre uno de ellos α-cetoglutarato, y esta reacción se produce mediante un centro de hierro mononuclear.
El cofactor implicado en las reacciones de dioxigenación más ampliamente observado es el hierro , pero el esquema catalítico empleado por estas enzimas que contienen hierro es muy diverso. Las dioxigenasas que contienen hierro se pueden subdividir en tres clases según cómo se incorpora el hierro al sitio activo: las que emplean un centro de hierro mononuclear, las que contienen un grupo de Rieske [2Fe-2S] y las que utilizan un grupo protésico hemo .
Las dioxigenasas de hierro mononucleares, o dioxigenasas no hemo dependientes de hierro, como también se las denomina, utilizan un único hierro catalítico para incorporar uno o ambos átomos de dioxígeno en un sustrato. A pesar de este evento de oxigenación común, las dioxigenasas de hierro mononucleares difieren en cómo se utiliza la activación de dioxígeno para promover ciertas reacciones químicas. [1] Por ejemplo, la escisión del enlace carbono-carbono, la hidroperoxidación de ácidos grasos, la escisión del enlace carbono-azufre y la oxidación de tiol son reacciones catalizadas por dioxigenasas de hierro mononucleares. [1] [2] [3]
La mayoría de las dioxigenasas de hierro mononucleares son miembros de la superfamilia de cupina en la que la estructura general del dominio se describe como un pliegue en barril β de seis hebras (o motivo de rollo de gelatina ). En el centro de esta estructura de barril hay un ion metálico, más comúnmente hierro ferroso, cuyo entorno de coordinación frecuentemente lo proporcionan residuos en dos motivos estructurales parcialmente conservados: G(X) 5 HXH(X) 3 - 4 E(X) 6 G y G(X) 5 - 7 PXG(X) 2 H(X) 3 N. [4] [5]
Dos grupos importantes de dioxigenasas de hierro mononucleares no hemo son las catecol dioxigenasas y las dioxigenasas dependientes de 2-oxoglutarato (2OG) . [6] Las catecol dioxigenasas , algunas de las enzimas dioxigenasas mejor estudiadas, utilizan dioxígeno para escindir un enlace carbono-carbono de un sistema de anillos de catecol aromático . [4] Las catecol dioxigenasas se clasifican además como “extradiol” o “intradiol”, y esta distinción se basa en diferencias mecanísticas en las reacciones (figuras 1 y 2). Las enzimas intraradiol escinden el enlace carbono-carbono entre los dos grupos hidroxilo. El centro férrico activo está coordinado por cuatro ligandos proteicos (dos residuos de histidina y dos de tirosinato ) de forma bipiramidal trigonal con una molécula de agua ocupando el quinto sitio de coordinación. [3] Una vez que un sustrato de catecolato se une al centro metálico de forma bidentada a través de los grupos hidroxilo desprotonados, el hierro férrico "activa" el sustrato mediante la extracción de un electrón para producir un radical en el sustrato. Esto luego permite que se produzca la reacción con dioxígeno y la posterior escisión del intradiol a través de un intermedio de anhídrido cíclico. [2] [4] Los miembros de Extradiol utilizan hierro ferroso como estado redox activo, y este centro comúnmente se coordina octaédricamente a través de un motivo 2-His-1-Glu con ligandos de agua lábiles que ocupan posiciones vacías. Una vez que un sustrato se une al centro ferroso, esto promueve la unión del dioxígeno y su posterior activación. [2] [4] [7] Esta especie de oxígeno activado luego procede a reaccionar con el sustrato y finalmente escinde el enlace carbono-carbono adyacente a los grupos hidroxilo mediante la formación de un intermedio de α-cetolactona. [3]
En las dioxigenasas dependientes de 2OG, el hierro ferroso ( Fe(II) ) también está coordinado por un motivo de "tríada facial" (His)2(Glu/Asp)1. La coordinación bidentada de 2OG y el agua completa una esfera de coordinación pseudooctaédrica. Después de la unión del sustrato, se libera el ligando agua, lo que genera un sitio de coordinación abierto para la activación del oxígeno. [6] Tras la unión del oxígeno, se produce una transformación poco conocida durante la cual el 2OG se descarboxila oxidativamente para formar succinato y el enlace OO se escinde para formar un intermedio Fe(IV)-oxo ( ferryl ). Este poderoso oxidante luego se utiliza para llevar a cabo diversas reacciones, incluidas la hidroxilación, la halogenación y la desmetilación. [8] En el caso mejor caracterizado, las hidroxilasas, el intermedio ferril extrae un átomo de hidrógeno de la posición objetivo del sustrato, produciendo un radical sustrato y Fe(III)-OH. Este radical luego se acopla al ligando hidróxido, produciendo el producto hidroxilado y el estado de reposo Fe(II) de la enzima. [8]
Las dioxigenasas de Rieske suelen catalizar la cis-dihidroxilación de arenos a productos cis-dihidrodiol. Estas dioxigenasas también catalizan la sulfoxidación, la desaturación y la oxidación bencílica. [2] Estas enzimas se encuentran de manera prominente en bacterias del suelo como Pseudomonas , [3] y sus reacciones constituyen el paso inicial en la biodegradación de los hidrocarburos aromáticos. [2] Las dioxigenasas de Rieske son estructuralmente más complejas que otras dioxigenasas debido a la necesidad de una vía eficiente de transferencia de electrones (figura 2) para mediar en la reducción adicional y simultánea de dos electrones del sustrato aromático.

Las dioxigenasas de Rieske tienen tres componentes: una FAD reductasa dependiente de NADH , una ferredoxina con dos grupos de Rieske [2Fe-2S] y una oxigenasa α3β3 en la que cada subunidad α contiene un centro de hierro mononuclear y un grupo de Rieske [2Fe-2S]. [2] Dentro de cada subunidad α, el grupo hierro-azufre y el centro mononuclear de hierro están separados por una distancia de ~43 Å, demasiado lejos para una transferencia eficiente de electrones . En cambio, se propone que la transferencia de electrones esté mediada a través de estos dos centros en subunidades adyacentes, que el grupo hierro-azufre de una subunidad transfiera electrones al centro de hierro mononuclear de la subunidad adyacente que está convenientemente separado por ~12 Å. Si bien esta distancia parecería óptima para una transferencia eficiente de electrones, la sustitución del residuo de aspartato puente provoca una pérdida de la función enzimática, lo que sugiere que la transferencia de electrones se realiza a través de la red de enlaces de hidrógeno mantenida en su lugar por este residuo de aspartato. [3]
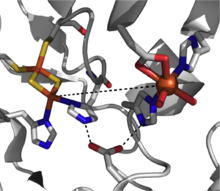
Se ha descrito el mecanismo de activación del O 2 por esta clase de dioxigenasas. [7] Esta especie podría representar el oxidante activo, o podría sufrir una escisión hemolítica del enlace OO para producir un intermedio hierro (V)-oxo como agente oxidante de trabajo. [3] [7]
Si bien la mayoría de las dioxigenasas dependientes de hierro utilizan un cofactor de hierro no hemo, la oxidación de L-(y D-)triptófano a N-formilquinurenina es catalizada por la triptófano 2,3-dioxigenasa (TDO) o la indoleamina 2,3-dioxigenasa ( IDO), que son hemo dioxigenasas que utilizan hierro coordinado por un grupo protésico hemo B. [9] [10] Si bien estas dioxigenasas son de interés en parte porque utilizan exclusivamente hemo para la catálisis, también lo son debido a su importancia en la regulación del triptófano en la célula, lo que tiene numerosas implicaciones fisiológicas. [11] Se cree que la asociación inicial del sustrato con el dioxígeno-hierro en el sitio activo de la enzima se produce mediante adición radical o electrófila, requiriendo hierro ferroso o hierro férrico, respectivamente. [9] Si bien el mecanismo de reacción exacto de las dioxigenasas dependientes de hemo aún está en debate, se postula que la reacción se produce a través de un mecanismo de dioxetano o de Criegee (figuras 4, 5). [9] [11]
Si bien el hierro es, con diferencia, el cofactor más utilizado para la dioxigenación enzimática, no todas las dioxigenasas lo requieren para la catálisis. La quercetina 2,3-dioxigenasa (quercetinasa, QueD) cataliza la escisión dioxigenolítica de la quercetina en ácido 2-protocatequioilfloroglucinolcarboxílico y monóxido de carbono . [12] La enzima más caracterizada, procedente de Aspergillus japonicus, requiere la presencia de cobre , [4] y se han descubierto quercetinasas bacterianas que son bastante promiscuas (cambialistas) [13] en sus requerimientos de un centro metálico, con distintos grados de actividad. reportado con sustitución de manganeso , cobalto , hierro, níquel y cobre divalentes . [12] (Quercetina, papel en el metabolismo). La acireductona (1,2-dihidroxi-5-(metiltio)pent-1-en-3-ona) dioxigenasa (ARD) se encuentra tanto en procariotas como en eucariotas . [4] [12] [14] Las enzimas ARD de la mayoría de las especies se unen al hierro ferroso y catalizan la oxidación de la acireductona a 4-(metiltio)-2-oxobutanoato, el α-cetoácido de la metionina y el ácido fórmico . Sin embargo, la ARD de Klebsiella oxytoca cataliza una reacción adicional cuando se une níquel (II): en su lugar produce 3-(metiltio)propionato, formiato y monóxido de carbono a partir de la reacción de acireductona con dioxígeno. La actividad de Fe-ARD está estrechamente entrelazada con la vía de recuperación de metionina, en la que el producto de metiltioadenosina de las reacciones celulares de S-adenosil metionina (SAM) finalmente se convierte en acireductona.
Si bien se desconoce el papel exacto de Ni-ARD, se sospecha que ayuda a regular los niveles de metionina al actuar como una derivación en la vía de rescate. Esta enzima de K. oxytoca representa un ejemplo único en el que el ion metálico presente dicta qué reacción se cataliza. Las quercetinasas y las enzimas ARD son miembros de la superfamilia de la cupina , a la que también pertenecen las enzimas mononucleares del hierro. [15] El esquema de coordinación de metales para las enzimas QueD es 3-His o 3-His-1-Glu y la disposición exacta es específica del organismo. [4] Todas las enzimas ARD quelan el metal catalítico (ya sea Ni o Fe) a través del motivo 3-His-1-Glu. [15] En estas dioxigenasas, los ligandos de coordinación son proporcionados por ambos motivos típicos de cupina. En las enzimas ARD, el metal existe en una disposición octaédrica con los tres residuos de histidina formando una tríada facial. [14] Los centros metálicos de quercetinasa bacteriana suelen tener un entorno de coordinación trigonal bipiramidal u octaédrico cuando hay cuatro ligandos proteicos; los centros metálicos de las enzimas QueD dependientes de cobre poseen una geometría tetraédrica distorsionada en la que sólo los tres residuos de histidina conservados proporcionan ligandos de coordinación. [4] [12] Los sitios de coordinación vacíos en todos los centros metálicos están ocupados por ligandos acuáticos hasta que son desplazados por el sustrato entrante.
La capacidad de estas dioxigenasas para retener actividad en presencia de otros cofactores metálicos con amplios rangos de potenciales redox sugiere que el centro metálico no desempeña un papel activo en la activación del dioxígeno. Más bien, se cree que el centro metálico funciona para mantener el sustrato en la geometría adecuada para que reaccione con el dioxígeno. En este sentido, estas enzimas recuerdan a las intradiolcatecol dioxigenasas, mediante las cuales los centros metálicos activan el sustrato para la posterior reacción con dioxígeno.

Las dioxigenasas que catalizan reacciones sin necesidad de un cofactor son mucho más raras en la naturaleza que aquellas que sí las requieren. Se ha demostrado que dos dioxigenasas, la 1H-3-hidroxi-4-oxo-quinolina 2,4-dioxigenasa (QDO) y la 1H-3-hidroxi-4-oxoquinaldina 2,4-dioxigenasa (HDO), no requieren una sustancia orgánica o cofactor metálico. [16] Estas enzimas catalizan la degradación de los heterociclos de quinolona de una manera similar a la quercetina dioxigenasa , pero se cree que median una reacción radical de una molécula de dioxígeno con un carbanión en el sustrato (figura 5). [17] Tanto HDO como QDO pertenecen a la superfamilia de enzimas α/β hidrolasa , aunque los residuos catalíticos en HDO y QDO no parecen cumplir la misma función que en el resto de las enzimas de la superfamilia α/β hidrolasa. . [dieciséis]
La diversidad en la familia de las dioxigenasas significa una amplia gama de funciones biológicas: