
Las didemninas son compuestos depsipeptídicos cíclicos aislados de un tunicado ( ascidia o ascidia) del género Trididemnum (familia de Didemnidæ ) que se recolectaron en el mar Caribe . Se aislaron por primera vez en 1978 en la Universidad de Illinois . [1]
Aunque se han aislado más de nueve didemninas (didemninas AE, G, X e Y) del extracto de Trididemnum solidum , la didemnina B es la que posee las actividades biológicas más potentes . [2] Es un fuerte agente antiviral contra virus de ADN y ARN como el virus del herpes simple tipo 1 , un fuerte inmunosupresor que muestra cierto potencial en el injerto de piel [3] y también es muy citotóxico . Muestra una fuerte actividad contra las células de leucemia murina . [4] Se sintetizaron químicamente grandes cantidades de didemnina B y el Instituto Nacional del Cáncer la adelantó a ensayos clínicos . Ha completado ensayos clínicos humanos de fase II contra el adenocarcinoma de riñón , [5] cáncer de ovario epitelial avanzado , [6] y cáncer de mama metastásico. [7] Desafortunadamente, el compuesto exhibió una alta toxicidad a través de una alta incidencia de reacciones anafilácticas en pacientes y los ensayos se terminaron. [8]
El análogo de didemnina plitidepsina se encontraba en ensayos clínicos de fase II en 2003. [9]
La biosíntesis del depsipéptido didemnina está regida por una vía híbrida de péptido sintetasa no ribosómica-policétido sintetasa (NRPS-PKS). La megasintetasa didemnina consta de 10 proteínas, de las cuales 8 son NRPS y 2 PKS, que abarcan 13 módulos en total. [10]
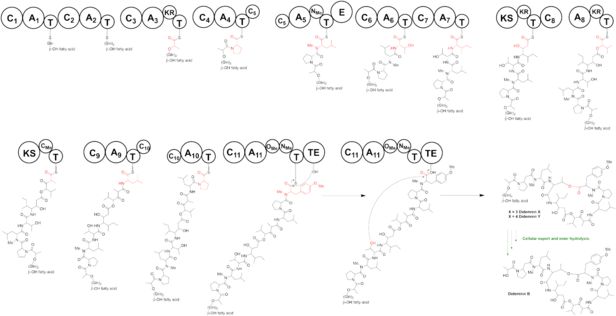
La vía propuesta de biosíntesis de la didemnina B comienza en Did A. Los módulos 1 y 2 incorporan una glicina en un ácido graso β-OH. En DidB, el dominio de adenilación (A) está cargado por piruvato y posteriormente reducido en su conformación cis por el dominio de cetorreductasa (KR), produciendo el lactato unido al dominio de tiolación (T). El didC monomodular incorpora prolina, antes de que el didD tridominio alargue la cadena peptídica con 3 aminoácidos. El dominio de adenilación (A) de didD está cargado con leucina y posteriormente N-metilado por el dominio de metiltransferasa (MT) y convertido en D-leucina N-metilada por el dominio de epimerasa (E). La leucina N-metilada es el único D-aminoácido en la didemnina B. El segundo módulo en didD incorpora treonina y el tercer módulo en el dominio unido isoleucina, ensamblando el tetrapéptido (Pro)-(N-Me-D-Leu)-(Thr)-(Ile). DidE es una PKS, pero carece de un dominio aciltransferasa (AT). El módulo 8 en didE une una β-hidroxi-γ-isostatina extendida con cetido. Se sugiere que la PKS de didemnina moviliza el dominio AT FabD de una sintetasa de ácidos grasos (FAS), ya que no hay un dominio AT presente en el genoma de didemina. El dominio DidF A está cargado con ácido 2-oxoisovalérico e incorpora ácido α-hidroxi 2-hidroxiisovalérico. El módulo 10 en PKS DidG agrega una segunda ronda de extensión de malonato. El dominio MT en DidG añade un grupo α-metilo a este residuo. Los dominios monomodulares DidH, DidI y DidJ alargan la cadena con leucina, prolina y tirosina respectivamente. Los dos dominios MT en DidJ metilan la tirosina dos veces, para producir N-metil-O-metil-tirosina, finalizando el ensamblaje de la didemnina B lineal. El dominio de tioesterasa (TE) en el módulo DidJ libera el producto en su forma ciclada.