El cloruro de níquel (II) (o simplemente cloruro de níquel ) es el compuesto químico NiCl 2 . La sal anhidra es amarilla, pero el hidrato más conocido NiCl 2 ·6H 2 O es verde. El cloruro de níquel (II), en varias formas, es la fuente más importante de níquel para la síntesis química. Los cloruros de níquel son delicuescentes y absorben la humedad del aire para formar una solución. Se ha demostrado que las sales de níquel son cancerígenas para los pulmones y las fosas nasales en casos de exposición prolongada a la inhalación . [4]
La producción y los usos a gran escala del cloruro de níquel están asociados con la purificación del níquel a partir de sus minerales. Se genera mediante la extracción de la mata de níquel y los residuos obtenidos a partir de la tostación y refinación de minerales que contienen níquel utilizando ácido clorhídrico. La electrólisis de soluciones de cloruro de níquel se utiliza en la producción de níquel metálico. Otras rutas importantes para obtener cloruro de níquel surgen del procesamiento de concentrados de minerales, como diversas reacciones que involucran cloruros de cobre: [5]
El cloruro de níquel no suele prepararse en el laboratorio porque es barato y tiene una larga vida útil. El dihidrato amarillento, NiCl 2 ·2H 2 O, se produce calentando el hexahidrato entre 66 y 133 °C. [6] Los hidratos se convierten en la forma anhidra al calentarlos en cloruro de tionilo o calentándolos bajo una corriente de gas HCl. El simple calentamiento de los hidratos no produce el dicloruro anhidro.
La deshidratación se acompaña de un cambio de color de verde a amarillo. [7]
En caso de necesitar un compuesto puro sin presencia de cobalto, se puede obtener cloruro de níquel calentando con cuidado cloruro de hexaammininíquel : [8]
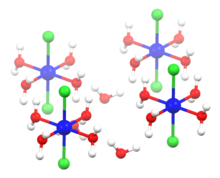
El NiCl 2 adopta la estructura CdCl 2 . [9] En este motivo, cada centro Ni 2+ está coordinado a seis centros Cl − , y cada cloruro está unido a tres centros Ni(II). En el NiCl 2 los enlaces Ni-Cl tienen "carácter iónico". El NiBr 2 amarillo y el NiI 2 negro adoptan estructuras similares, pero con un empaquetamiento diferente de los haluros, adoptando el motivo CdI 2 .
Por el contrario, el NiCl 2 ·6H 2 O consiste en moléculas trans -[NiCl 2 (H 2 O) 4 ] separadas unidas más débilmente a moléculas de agua adyacentes. Solo cuatro de las seis moléculas de agua en la fórmula están unidas al níquel, y las dos restantes son agua de cristalización , por lo que la fórmula del cloruro de níquel (II) hexahidratado es [NiCl 2 (H 2 O) 4 ]·2H 2 O. [9] El cloruro de cobalto (II) hexahidratado tiene una estructura similar. El hexahidrato se presenta en la naturaleza como el mineral muy raro niquelbischofito.
El dihidrato NiCl 2 ·2H 2 O adopta una estructura intermedia entre el hexahidrato y las formas anhidras. Consiste en cadenas infinitas de NiCl 2 , donde ambos centros de cloruro son ligandos puente . Los sitios trans en los centros octaédricos están ocupados por ligandos acuosos . [10] También se conoce un tetrahidrato NiCl 2 ·4H 2 O.
Las soluciones de cloruro de níquel (II) son ácidas, con un pH de alrededor de 4 debido a la hidrólisis del ion Ni 2+ .
_complexes_in_aqueous_solution.jpg/440px-Color_of_various_Ni(II)_complexes_in_aqueous_solution.jpg)
La mayoría de las reacciones atribuidas al "cloruro de níquel" involucran el hexahidrato, aunque reacciones especializadas requieren la forma anhidra .
Las reacciones que comienzan con NiCl2 · 6H2O se pueden utilizar para formar una variedad de complejos de coordinación de níquel porque los ligandos H2O son desplazados rápidamente por amoníaco , aminas , tioéteres , tiolatos y organofosfinas . En algunos derivados, el cloruro permanece dentro de la esfera de coordinación , mientras que el cloruro es desplazado con ligandos altamente básicos. Los complejos ilustrativos incluyen:
El NiCl2 es el precursor de los complejos de acetilacetonato Ni(acac) 2 ( H2O ) 2 y del (Ni(acac) 2 ) 3 soluble en benceno , que es un precursor del Ni(1,5-ciclooctadieno) 2 , un reactivo importante en la química del organoníquel.
En presencia de eliminadores de agua, el cloruro de níquel (II) hidratado reacciona con dimetoxietano (dme) para formar el complejo molecular NiCl 2 (dme) 2 . [6] Los ligandos dme en este complejo son lábiles.
El NiCl2 y su hidrato son ocasionalmente útiles en la síntesis orgánica . [13]
Se utiliza NiCl 2 -dme (o NiCl 2 -glima) debido a su mayor solubilidad en comparación con el hexahidrato. [14]

El cloruro de níquel (II) es irritante por ingestión, inhalación, contacto con la piel y con los ojos. La exposición prolongada por inhalación al níquel y sus compuestos se ha relacionado con un mayor riesgo de cáncer de pulmón y fosas nasales. [4]