
Un detergente es un surfactante o una mezcla de surfactantes con propiedades limpiadoras cuando se encuentran en soluciones diluidas . [1] Existe una gran variedad de detergentes, una familia común son los alquilbencenosulfonatos , que son compuestos similares al jabón que son más solubles en agua dura , porque el sulfonato polar (de los detergentes) tiene menos probabilidades que el carboxilato polar (del jabón) de unirse al calcio y otros iones que se encuentran en el agua dura.
La palabra detergente se deriva del adjetivo latino detergens , del verbo detergere , que significa limpiar o pulir. El detergente puede definirse como un tensioactivo o una mezcla de tensioactivos con propiedades limpiadoras cuando se encuentran en soluciones diluidas . [1] Sin embargo, convencionalmente, detergente se utiliza para referirse a compuestos de limpieza sintéticos en lugar de jabón (una sal del ácido graso natural ), aunque el jabón también es un detergente en el verdadero sentido. [2] En contextos domésticos, el término detergente se refiere a productos de limpieza del hogar como el detergente para ropa o el detergente para platos , que son de hecho mezclas complejas de diferentes compuestos, no todos los cuales son en sí mismos detergentes.
La detergencia es la capacidad de eliminar sustancias no deseadas denominadas "suciedad" de un sustrato (por ejemplo, ropa). [3]
Los detergentes son un grupo de compuestos con una estructura anfifílica, donde cada molécula tiene una cabeza hidrófila (polar) y una cola hidrófoba larga (apolar). La porción hidrófoba de estas moléculas puede ser hidrocarburos de cadena lineal o ramificada , o puede tener una estructura esteroide . La porción hidrófila es más variada, pueden ser iónicas o no iónicas, y pueden variar desde una estructura simple hasta una relativamente elaborada. [4] Los detergentes son surfactantes ya que pueden disminuir la tensión superficial del agua. Su naturaleza dual facilita la mezcla de compuestos hidrófobos (como aceite y grasa) con agua. Debido a que el aire no es hidrófilo, los detergentes también son agentes espumantes en diversos grados.
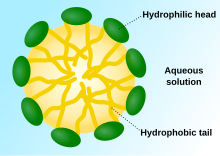
Las moléculas de detergente se agregan para formar micelas , lo que las hace solubles en agua. El grupo hidrófobo del detergente es la principal fuerza impulsora de la formación de micelas; su agregación forma el núcleo hidrófobo de las micelas. La micela puede eliminar grasa, proteínas o partículas de suciedad. La concentración a la que comienzan a formarse las micelas es la concentración micelar crítica (CMC), y la temperatura a la que las micelas se agregan aún más para separar la solución en dos fases es el punto de enturbiamiento cuando la solución se vuelve turbia y la detergencia es óptima. [4]
Los detergentes funcionan mejor en un pH alcalino. Las propiedades de los detergentes dependen de la estructura molecular del monómero . La capacidad de formar espuma puede estar determinada por el grupo principal; por ejemplo, los surfactantes aniónicos son muy espumantes, mientras que los surfactantes no iónicos pueden ser poco o nada espumantes. [5]
Los detergentes se clasifican en cuatro grandes grupos, dependiendo de la carga eléctrica de los tensioactivos. [6]
Los detergentes aniónicos típicos son los sulfonatos de alquilbenceno . La porción de alquilbenceno de estos aniones es lipofílica y el sulfonato es hidrófilo. Se han popularizado dos variedades, las que tienen grupos alquilo ramificados y las que tienen grupos alquilo lineales. Las primeras fueron eliminadas en gran medida en las sociedades económicamente avanzadas porque son poco biodegradables. [7]
Los detergentes aniónicos son la forma más común de detergentes y se estima que anualmente se producen 6 mil millones de kilogramos de detergentes aniónicos para los mercados domésticos.
Los ácidos biliares , como el ácido desoxicólico (DOC), son detergentes aniónicos producidos por el hígado para ayudar en la digestión y absorción de grasas y aceites.

Los detergentes catiónicos son similares a los aniónicos, pero el amonio cuaternario reemplaza al grupo sulfonato aniónico hidrofílico. El centro de sulfato de amonio tiene carga positiva. [7] Los surfactantes catiónicos generalmente tienen una detergencia deficiente.
Los detergentes no iónicos se caracterizan por sus grupos de cabeza hidrófilos sin carga. Los detergentes no iónicos típicos se basan en polioxietileno o un glicósido . Los ejemplos comunes de los primeros incluyen Tween , Triton y la serie Brij. Estos materiales también se conocen como etoxilatos o PEGilatos y sus metabolitos, nonilfenol . Los glicósidos tienen un azúcar como su grupo de cabeza hidrófilo sin carga. Los ejemplos incluyen octiltioglucósido y maltósidos . Los detergentes de las series HEGA y MEGA son similares, poseen un alcohol de azúcar como grupo de cabeza.
Los detergentes anfóteros o zwitteriónicos tienen iones zwitteriónicos dentro de un rango de pH particular y poseen una carga neta cero que surge de la presencia de cantidades iguales de grupos químicos con carga +1 y -1. Algunos ejemplos incluyen CHAPS .
Se sabe que el jabón se ha utilizado como surfactante para lavar la ropa desde la época sumeria en el año 2500 a. C. [8] En el antiguo Egipto , la soda se utilizaba como aditivo para el lavado. En el siglo XIX, comenzaron a crearse surfactantes sintéticos, por ejemplo a partir del aceite de oliva. [9] El silicato de sodio (vidrio de agua) se utilizó en la fabricación de jabón en los Estados Unidos en la década de 1860, [10] y en 1876, Henkel vendió un producto a base de silicato de sodio que se puede utilizar con jabón y se comercializó como un "detergente universal" ( Universalwaschmittel ) en Alemania. Luego, la soda se mezcló con silicato de sodio para producir el primer detergente de marca de Alemania, Bleichsoda. [11] En 1907, Henkel también agregó un agente blanqueador, perborato de sodio, para lanzar el primer detergente para ropa "autoactuante" Persil para eliminar el laborioso frotado de la ropa a mano. [12]
Durante la Primera Guerra Mundial , hubo escasez de aceites y grasas necesarios para hacer jabón. Con el fin de encontrar alternativas para el jabón, los químicos alemanes fabricaron detergentes sintéticos utilizando materia prima derivada del alquitrán de hulla. [13] [14] [9] Sin embargo, estos primeros productos no proporcionaban suficiente detergencia. En 1928, se fabricó un detergente eficaz mediante la sulfatación de alcohol graso , pero la producción a gran escala no fue factible hasta que los alcoholes grasos de bajo costo estuvieron disponibles a principios de la década de 1930. [15] El detergente sintético creado fue más eficaz y tenía menos probabilidades de formar espuma que el jabón en agua dura, y también puede eliminar las reacciones ácidas y alcalinas y descomponer la suciedad. Los productos detergentes comerciales con sulfatos de alcohol graso comenzaron a venderse, inicialmente en 1932 en Alemania por Henkel . [15] En los Estados Unidos, los detergentes fueron vendidos en 1933 por Procter & Gamble ( Dreft ) principalmente en áreas con agua dura. [14] Sin embargo, las ventas en los EE. UU. crecieron lentamente hasta la introducción de detergentes "construidos" con la adición de un eficaz constructor de fosfato desarrollado a principios de la década de 1940. [14] El constructor mejora el rendimiento de los surfactantes al suavizar el agua a través de la quelación de iones de calcio y magnesio, lo que ayuda a mantener un pH alcalino, además de dispersar y mantener las partículas sucias en solución. [16] El desarrollo de la industria petroquímica después de la Segunda Guerra Mundial también produjo material para la producción de una gama de surfactantes sintéticos, y los sulfonatos de alquilbenceno se convirtieron en los surfactantes detergentes más importantes utilizados. [17] En la década de 1950, los detergentes para ropa se habían generalizado y reemplazaron en gran medida al jabón para limpiar la ropa en los países desarrollados. [15]
A lo largo de los años, se han desarrollado muchos tipos de detergentes para una variedad de propósitos, por ejemplo, detergentes de baja espuma para usar en lavadoras de carga frontal, detergentes de alta resistencia eficaces para eliminar la grasa y la suciedad, detergentes multiusos y detergentes especiales. [14] [18] Se incorporan en varios productos fuera del uso de lavandería, por ejemplo en detergentes para lavavajillas , champú, pasta de dientes, limpiadores industriales y en lubricantes y combustibles para reducir o prevenir la formación de lodos o depósitos. [19] La formulación de productos detergentes puede incluir blanqueador , fragancias, colorantes y otros aditivos. Sin embargo, el uso de fosfatos en detergentes generó preocupaciones sobre la contaminación por nutrientes y la demanda de cambios en la formulación de los detergentes. [20] También se plantearon preocupaciones sobre el uso de surfactantes como el sulfonato de alquilbenceno ramificado (sulfonato de tetrapropilenbenceno) que permanece en el medio ambiente, lo que llevó a su reemplazo por surfactantes que son más biodegradables, como el sulfonato de alquilbenceno lineal. [15] [17] Los desarrollos a lo largo de los años han incluido el uso de enzimas , sustitutos de fosfatos como la zeolita A y NTA , TAED como activador de blanqueador , surfactantes a base de azúcar que son biodegradables y más suaves para la piel, y otros productos ecológicos , así como cambios en la forma de administración, como tabletas, geles y cápsulas . [21] [22]

Una de las aplicaciones más importantes de los detergentes es la limpieza de hogares y comercios, incluido el lavado de vajilla y de ropa . Estos detergentes suelen estar disponibles en forma de polvos o soluciones concentradas, y sus formulaciones suelen ser mezclas complejas de una variedad de productos químicos además de los surfactantes, lo que refleja las diversas demandas de la aplicación y el mercado de consumo altamente competitivo. Estos detergentes pueden contener los siguientes componentes: [21]
Tanto los carburadores como los componentes de los inyectores de combustible de los motores de combustión interna se benefician de los detergentes en los combustibles para evitar la formación de incrustaciones . Las concentraciones son de aproximadamente 300 ppm . Los detergentes típicos son las aminas y amidas de cadena larga, como la poliisobutenoamina y la poliisobutenoamida/ succinimida . [23]
Los detergentes de grado reactivo se emplean para el aislamiento y la purificación de proteínas integrales de membrana que se encuentran en células biológicas . [24] La solubilización de las bicapas de la membrana celular requiere un detergente que pueda entrar en la monocapa de la membrana interna . [25 ] Los avances en la pureza y sofisticación de los detergentes han facilitado la caracterización estructural y biofísica de proteínas de membrana importantes, como los canales iónicos, que también alteran la membrana uniéndose a lipopolisacáridos , [26] transportadores , receptores de señalización y fotosistema II . [27]