
La teoría de los filamentos deslizantes explica el mecanismo de contracción muscular basándose en proteínas musculares que se deslizan unas sobre otras para generar movimiento. [1] Según la teoría de los filamentos deslizantes, la miosina ( filamentos gruesos ) de las fibras musculares se deslizan más allá de la actina ( filamentos delgados ) durante la contracción muscular, mientras que los dos grupos de filamentos permanecen en una longitud relativamente constante.
La teoría fue introducida de forma independiente en 1954 por dos equipos de investigación, uno formado por Andrew Huxley y Rolf Niedergerke de la Universidad de Cambridge , y el otro formado por Hugh Huxley y Jean Hanson del Instituto Tecnológico de Massachusetts . [2] [3] Fue concebida originalmente por Hugh Huxley en 1953. Andrew Huxley y Niedergerke la presentaron como una hipótesis "muy atractiva". [4]
Antes de la década de 1950, existían varias teorías en competencia sobre la contracción muscular, que incluían la atracción eléctrica, el plegamiento de proteínas y la modificación de proteínas. [5] La nueva teoría introdujo directamente un nuevo concepto llamado teoría del puente cruzado (clásicamente, puente cruzado oscilante, ahora conocido principalmente como ciclo de puente cruzado ) que explica el mecanismo molecular del filamento deslizante. La teoría del puente cruzado establece que la actina y la miosina forman un complejo proteico (clásicamente llamado actomiosina ) mediante la unión de la cabeza de miosina al filamento de actina, formando así una especie de puente cruzado entre los dos filamentos. La teoría del filamento deslizante es una explicación ampliamente aceptada del mecanismo que subyace a la contracción muscular. [6]
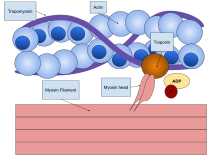

La primera proteína muscular descubierta fue la miosina por un científico alemán Willy Kühne , quien la extrajo y la nombró en 1864. [7] En 1939, un equipo de marido y mujer rusos, Vladimir Alexandrovich Engelhardt y Militsa Nikolaevna Lyubimova, descubrieron que la miosina tenía una propiedad enzimática (llamada ATPasa ) que puede descomponer el ATP para liberar energía. [8] Albert Szent-Györgyi , un fisiólogo húngaro, centró su atención en la fisiología muscular después de ganar el Premio Nobel de Fisiología o Medicina en 1937 por sus trabajos sobre la vitamina C y el ácido fumárico . Demostró en 1942 que el ATP era la fuente de energía para la contracción muscular. De hecho, observó que las fibras musculares que contenían miosina B se acortaban en presencia de ATP, pero no con miosina A, la experiencia que más tarde describió como "quizás el momento más emocionante de mi vida". [9] Junto con Brunó Ferenc Straub , pronto descubrió que la miosina B estaba asociada con otra proteína, a la que llamaron actina, mientras que la miosina A no. Straub purificó la actina en 1942 y Szent-Györgyi purificó la miosina A en 1943. Se hizo evidente que la miosina B era una combinación de miosina A y actina, de modo que la miosina A conservó el nombre original, mientras que ellos rebautizaron la miosina B como actomiosina. A finales de la década de 1940, el equipo de Szent-Györgyi había postulado con evidencia que la contracción de la actomiosina era equivalente a la contracción muscular en su conjunto. [10] Pero la noción fue generalmente rechazada, incluso por parte de premios Nobel como Otto Fritz Meyerhof y Archibald Hill , que se adhirieron al dogma prevaleciente de que la miosina era una proteína estructural y no una enzima funcional. [3] Sin embargo, en una de sus últimas contribuciones a la investigación muscular, Szent-Györgyi demostró que la actomiosina impulsada por ATP era el principio básico de la contracción muscular. [11]

Cuando Hugh Huxley obtuvo su doctorado en la Universidad de Cambridge en 1952 por su investigación sobre la estructura del músculo, Szent-Györgyi había volcado su carrera en la investigación del cáncer. [12] Huxley fue al laboratorio de Francis O. Schmitt en el Instituto Tecnológico de Massachusetts con una beca postdoctoral en septiembre de 1952, donde se le unió otro becario postdoctoral inglés, Jean Hanson, en enero de 1953. Hanson tenía un doctorado en estructura muscular del King's College de Londres en 1951. Huxley había utilizado la difracción de rayos X para especular que las proteínas musculares, particularmente la miosina, forman filamentos estructurados que dan lugar al sarcómero (un segmento de fibra muscular). Su principal objetivo era utilizar la microscopía electrónica para estudiar los detalles de esos filamentos como nunca antes se había hecho. Pronto descubrieron y confirmaron la naturaleza filamentosa de las proteínas musculares. La miosina y la actina forman filamentos superpuestos, los filamentos de miosina constituyen principalmente la banda A (la región oscura de un sarcómero), mientras que los filamentos de actina atraviesan las bandas A e I (región clara). [13] Huxley fue el primero en sugerir la teoría de filamentos deslizantes en 1953, afirmando:
“… [S]i se postula que el estiramiento del músculo se produce, no por una extensión de los filamentos, sino por un proceso en el que los dos conjuntos de filamentos se deslizan [énfasis añadido] uno sobre el otro; la extensibilidad se inhibirá entonces si la miosina y la actina están unidas entre sí”. [14]
Más tarde, en 1996, Huxley lamentó haber incluido a Hanson en la formulación de su teoría porque estaba basada en su trabajo colaborativo. [15]
Andrew Huxley , a quien Alan Hodgkin describió como "un mago con aparatos científicos", acababa de descubrir el mecanismo de transmisión del impulso nervioso ( potencial de acción ) (por el que él y Hodgkin ganaron más tarde el Premio Nobel de Fisiología o Medicina en 1963) en 1949 utilizando su propio diseño de pinza de voltaje , y estaba buscando un socio que pudiera diseccionar adecuadamente las fibras musculares. [16] Por recomendación de un amigo cercano Robert Stämpfli, un médico alemán Rolf Niedergerke se unió a él en la Universidad de Cambridge en 1952. Para entonces, se dio cuenta de que el microscopio de contraste de fases utilizado convencionalmente no era adecuado para las estructuras finas de las fibras musculares, y así desarrolló su propio microscopio de interferencia . Entre marzo de 1953 y enero de 1954 llevaron a cabo su investigación. [17] Huxley recordó que en ese momento la única persona que había pensado en filamentos deslizantes antes de 1953 fue Dorothy Hodgkin (posteriormente ganadora del Premio Nobel de Química en 1964 ). [18] Pasó el verano de 1953 en el Laboratorio de Biología Marina en Woods Hole, Massachusetts, para utilizar allí el microscopio electrónico. Allí conoció a Hugh Huxley y Hanson con quienes compartió datos e información sobre sus trabajos. Se despidieron con un acuerdo de que se mantendrían en contacto y, cuando se lograra su objetivo, publicarían juntos, si alguna vez "llegaban a conclusiones similares". [2]

La teoría de los filamentos deslizantes surgió de dos artículos consecutivos publicados en la edición del 22 de mayo de 1954 de la revista Nature bajo el tema común "Cambios estructurales en los músculos durante la contracción". Aunque sus conclusiones eran fundamentalmente similares, los datos experimentales y las proposiciones subyacentes eran diferentes.
El primer artículo, escrito por Andrew Huxley y Rolf Niedergerke, se titula “Microscopía de interferencia de fibras musculares vivas”. Se basa en su estudio del músculo de la rana utilizando un microscopio de interferencia, que Andrew Huxley desarrolló para ese fin. Según ellos: [4]
El segundo artículo, de Hugh Huxley y Jean Hanson, se titula "Cambios en las estrías transversales del músculo durante la contracción y el estiramiento y su interpretación estructural". Es más elaborado y se basó en su estudio del músculo de conejo utilizando microscopios electrónicos y de contraste de fase. Según ellos: [19]
A pesar de la evidencia sólida, la teoría de los filamentos deslizantes no obtuvo ningún apoyo durante varios años. [20] El propio Szent-Györgyi se negó a creer que los filamentos de miosina estuvieran confinados en el filamento grueso (banda A). [15] FO Schmitt, cuyo microscopio electrónico proporcionó los mejores datos, también se mantuvo escéptico respecto de las imágenes originales. [21] También hubo argumentos inmediatos sobre la organización de los filamentos, si los dos conjuntos de filamentos (miosina y actina) estaban simplemente superpuestos o eran continuos. Fue solo con el nuevo microscopio electrónico que Hugh Huxley confirmó la naturaleza superpuesta de los filamentos en 1957. [22] También fue a partir de esta publicación que se demostró claramente la existencia del enlace actina-miosina (ahora llamado puente cruzado). Pero tardó otros cinco años en proporcionar evidencia de que el puente cruzado era una interacción dinámica entre los filamentos de actina y miosina. [23] Obtuvo la disposición molecular real de los filamentos utilizando cristalografía de rayos X al asociarse con Kenneth Holmes , quien fue entrenado por Rosalind Franklin , en 1965. [24] Fue solo después de una conferencia en 1972 en Cold Spring Harbor Laboratory , donde se deliberaron la teoría y su evidencia, que se aceptó generalmente. [25] En la conferencia, como Koscak Maruyama recordó más tarde, Hanson tuvo que responder a las críticas gritando: "Sé que todavía no puedo explicar el mecanismo, pero el deslizamiento es un hecho". [26] Las pruebas fácticas llegaron a principios de la década de 1980 cuando se pudo demostrar el movimiento deslizante real utilizando herramientas novedosas y sofisticadas por diferentes investigadores. [27] [28] [29]
Con evidencia sustancial, Hugh Huxley propuso formalmente el mecanismo para el deslizamiento de filamentos que se llama de diversas maneras modelo de puente cruzado oscilante, teoría de puente cruzado o modelo de puente cruzado. [3] [30] (Él mismo prefirió el nombre "modelo de puente cruzado oscilante", porque, como recordó, "fue [el descubrimiento], después de todo, en la década de 1960". [2] ) Publicó su teoría en la edición del 20 de junio de 1969 de Science bajo el título "El mecanismo de contracción muscular". [31] Según su teoría, el deslizamiento de filamentos ocurre por unión y desprendimiento cíclicos de miosina en filamentos de actina. La contracción ocurre cuando la miosina tira del filamento de actina hacia el centro de la banda A, se separa de la actina y crea una fuerza (golpe) para unirse a la siguiente molécula de actina. [32] Esta idea fue posteriormente probada en detalle, y es más apropiadamente conocida como el ciclo de puente cruzado . [33]