Nafion es una marca comercial de un fluoropolímero - copolímero basado en tetrafluoroetileno sulfonado sintetizado en 1962 por el Dr. Donald J. Connolly en la Estación Experimental DuPont en Wilmington Delaware (Patente de EE. UU. 3.282.875). El Dr. Walther Grot de DuPont realizó trabajos adicionales sobre la familia de polímeros a fines de la década de 1960. [1] Nafion es una marca de la empresa Chemours . Es el primero de una clase de polímeros sintéticos con propiedades iónicas que se denominan ionómeros . Las propiedades iónicas únicas de Nafion son el resultado de la incorporación de grupos de éter de perfluorovinilo terminados con grupos sulfonato en una cadena principal de tetrafluoroetileno ( PTFE ). [2] [3] [4] Nafion ha recibido una cantidad considerable de atención como conductor de protones para celdas de combustible de membrana de intercambio de protones (PEM) debido a su excelente estabilidad química y mecánica en las duras condiciones de esta aplicación.
La base química de las propiedades conductoras de iones de Nafion sigue siendo un foco de amplia investigación. [2] La conductividad iónica de Nafion aumenta con el nivel de hidratación. La exposición de Nafion a un entorno humidificado o agua líquida aumenta la cantidad de moléculas de agua asociadas con cada grupo de ácido sulfónico. La naturaleza hidrófila de los grupos iónicos atrae moléculas de agua, que comienzan a solvatar los grupos iónicos y disocian los protones del grupo -SO 3 H ( ácido sulfónico ). Los protones disociados "saltan" de un sitio ácido a otro a través de mecanismos facilitados por las moléculas de agua y los enlaces de hidrógeno . [2] Tras la hidratación, Nafion se separa en fases a escalas de longitud nanométricas, lo que da como resultado la formación de una red interconectada de dominios hidrófilos que permiten el movimiento de agua y cationes , pero las membranas no conducen electrones y conducen mínimamente aniones debido a la permeselectividad (exclusión basada en carga). El Nafion se puede fabricar con o intercambiar con formas de cationes alternativas para diferentes aplicaciones (por ejemplo, litiado para baterías de iones de litio) y en diferentes pesos equivalentes (EW), considerados alternativamente como capacidades de intercambio iónico (IEC), para lograr una gama de conductividades catiónicas con compensaciones con otras propiedades fisicoquímicas como la absorción de agua y la hinchazón.
El nafión se puede producir tanto como resina en polvo como copolímero . Tiene varias configuraciones químicas y, por lo tanto, varios nombres químicos en el sistema IUPAC . El nafión-H, por ejemplo, incluye los siguientes nombres sistemáticos:
El peso molecular de Nafion es variable debido a las diferencias en el procesamiento y la morfología de la solución. [3] [4] La estructura de una unidad de Nafion ilustra la variabilidad del material; por ejemplo, el monómero más básico contiene variación de cadena entre los grupos éter (el subíndice z). Los métodos convencionales para determinar el peso molecular, como la dispersión de luz y la cromatografía de permeación en gel, no son aplicables porque Nafion es insoluble, aunque el peso molecular se ha estimado en 10 5 –10 6 Da. [3] [4] En cambio, el peso equivalente (EW) y el espesor del material se utilizan para describir la mayoría de las membranas disponibles comercialmente. El EW es el número de gramos de Nafion seco por mol de grupos de ácido sulfónico cuando el material está en forma ácida. [4] Las membranas de Nafion se clasifican comúnmente en términos de su EW y espesor. [2] [5] Por ejemplo, Nafion 117 indica una membrana moldeada por extrusión con 1100 g/mol EW y 0,007 pulgadas (7 milésimas) de espesor. [5] A diferencia del peso equivalente, las resinas de intercambio iónico convencionales se describen generalmente en términos de su capacidad de intercambio iónico (IEC), que es el inverso multiplicativo o recíproco del peso equivalente, es decir, IEC = 1000/EW.
Los derivados de nafión se sintetizan primero mediante la copolimerización de tetrafluoroetileno (TFE) (el monómero del teflón) y un derivado de un perfluoro (éter vinílico de alquilo) con fluoruro de ácido sulfonílico. Este último reactivo se puede preparar mediante la pirólisis de su respectivo óxido o ácido carboxílico para dar la estructura olefinada. [6]
El producto resultante es un termoplástico que contiene -SO 2 F que se extruye en películas. El NaOH acuoso caliente convierte estos grupos de fluoruro de sulfonilo (-SO 2 F) en grupos de sulfonato (-SO 3 − Na + ). Esta forma de Nafion, denominada forma neutra o de sal, finalmente se convierte en la forma ácida que contiene los grupos de ácido sulfónico (-SO 3 H). El Nafion se puede dispersar en solución calentando en alcohol acuoso a 250 °C en un autoclave para su posterior fundición en películas delgadas o su uso como aglutinante polimérico en electrodos. Mediante este proceso, el Nafion se puede utilizar para generar películas compuestas, recubrir electrodos o reparar membranas dañadas. [3]
La combinación de la cadena principal estable de PTFE con los grupos sulfónicos ácidos le da a Nafion sus características: [2] [7]
La morfología de las membranas de Nafion es un tema de estudio continuo para permitir un mayor control de sus propiedades. Otras propiedades como la gestión del agua, la estabilidad de la hidratación a altas temperaturas, el arrastre electroosmótico , así como la estabilidad mecánica, térmica y oxidativa, se ven afectadas por la estructura del Nafion. Se han propuesto varios modelos para la morfología del Nafion para explicar sus propiedades de transporte únicas. [2]

El primer modelo para Nafion, llamado modelo de canal de racimo o modelo de red de racimo , consistió en una distribución igual de grupos de iones de sulfonato (también descritos como ' micelas invertidas ' [4] ) con un diámetro de 40 Å (4 nm ) mantenidos dentro de una red continua de fluorocarbono. Canales estrechos de aproximadamente 10 Å (1 nm) de diámetro interconectan los grupos, lo que explica las propiedades de transporte. [3] [4] [12]
La dificultad para determinar la estructura exacta del Nafion se debe a la inconsistencia de la solubilidad y la estructura cristalina entre sus diversos derivados. Los modelos morfológicos avanzados han incluido un modelo de núcleo-capa donde el núcleo rico en iones está rodeado por una capa pobre en iones, un modelo de varilla donde los grupos sulfónicos se organizan en varillas similares a cristales y un modelo de sándwich donde el polímero forma dos capas cuyos grupos sulfónicos se atraen a través de una capa acuosa donde se produce el transporte. [4] La coherencia entre los modelos incluye una red de cúmulos iónicos; los modelos difieren en la geometría y distribución de los cúmulos. Aunque todavía no se ha determinado que ningún modelo sea completamente correcto, algunos científicos han demostrado que a medida que la membrana se hidrata, la morfología del Nafion se transforma del modelo de cúmulo-canal a un modelo similar a una varilla. [4]
También se propuso un modelo de canal de agua cilíndrico [13] basado en simulaciones de datos de dispersión de rayos X de ángulo pequeño y estudios de resonancia magnética nuclear de estado sólido. En este modelo, los grupos funcionales de ácido sulfónico se autoorganizan en matrices de canales de agua hidrófilos, cada uno de ~ 2,5 nm de diámetro, a través de los cuales se pueden transportar fácilmente iones pequeños. Entre los canales hidrófilos se intercalan cadenas principales de polímeros hidrófobos que proporcionan la estabilidad mecánica observada. Sin embargo, muchos estudios recientes favorecieron una nanoestructura separada por fases que consiste en dominios hidrófilos localmente planos o en forma de cinta basados en evidencia de estudios de imágenes directas [14] y análisis más completos de la estructura y las propiedades de transporte. [2] [15]
Las propiedades del Nafion lo hacen adecuado para una amplia gama de aplicaciones. El Nafion se ha utilizado en celdas de combustible , dispositivos electroquímicos, producción de cloro-álcali, recuperación de iones metálicos, electrólisis de agua , enchapado , tratamiento de superficies de metales, baterías, sensores , celdas de diálisis Donnan, liberación de fármacos, secado o humidificación de gases y catálisis superácida para la producción de productos químicos finos. [3] [4] [7] [16] El Nafion también se cita a menudo por su potencial teórico (es decir, hasta ahora no probado) en varios campos. Teniendo en cuenta la amplia funcionalidad del Nafion, a continuación solo se analizarán las más significativas.
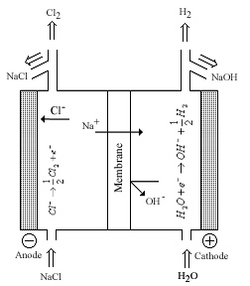
El cloro y el hidróxido de sodio/potasio se encuentran entre los productos químicos básicos más producidos en el mundo. Los métodos de producción modernos producen Cl2 y NaOH/KOH a partir de la electrólisis de salmuera utilizando una membrana de Nafion entre semiceldas. Antes del uso de Nafion, las industrias utilizaban amalgama de sodio que contenía mercurio para separar el sodio metálico de las celdas o diafragmas de amianto para permitir la transferencia de iones de sodio entre semiceldas; ambas tecnologías se desarrollaron en la segunda mitad del siglo XIX. Las desventajas de estos sistemas son la seguridad de los trabajadores y las preocupaciones ambientales asociadas con el mercurio y el amianto, los factores económicos también jugaron un papel, y en el proceso del diafragma la contaminación por cloruro del producto de hidróxido. Nafion fue el resultado directo de la industria cloroalcalina que abordó estas preocupaciones; Nafion podía tolerar las altas temperaturas, las altas corrientes eléctricas y el entorno corrosivo de las celdas electrolíticas. [3] [4] [7]
La figura de la derecha muestra una celda de cloro-álcali donde el Nafion funciona como una membrana entre las semiceldas. La membrana permite que los iones de sodio se transfieran de una celda a la otra con una resistencia eléctrica mínima. La membrana también se reforzó con membranas adicionales para evitar la mezcla de productos gaseosos y minimizar la transferencia inversa de iones Cl − y − OH. [3]
Aunque las pilas de combustible se han utilizado desde la década de 1960 como fuentes de energía para satélites, recientemente han recibido una renovada atención por su potencial para producir de manera eficiente energía limpia a partir del hidrógeno. Se descubrió que el Nafion era eficaz como membrana para las pilas de combustible de membrana de intercambio de protones (PEM), ya que permite el transporte de iones de hidrógeno al tiempo que evita la conducción de electrones. Los electrolitos de polímero sólido, que se fabrican conectando o depositando electrodos (generalmente de metal noble) a ambos lados de la membrana, conducen los electrones a través de un proceso que requiere energía y vuelven a unir los iones de hidrógeno para reaccionar con el oxígeno y producir agua. [3] Se espera que las pilas de combustible encuentren un uso importante en la industria del transporte.
El nafión, como superácido , tiene potencial como catalizador para la síntesis orgánica . Los estudios han demostrado propiedades catalíticas en alquilación , isomerización , oligomerización , acilación , cetalización , esterificación , hidrólisis de azúcares y éteres y oxidación . Constantemente se descubren nuevas aplicaciones. [16] Sin embargo, estos procesos aún no han encontrado un uso comercial sólido. A continuación se muestran varios ejemplos:
El Nafion-H proporciona una conversión eficiente mientras que el método alternativo, que emplea la síntesis de Friedel-Crafts , puede promover la polialquilación: [17]
La cantidad de Nafion-H necesaria para catalizar la acilación de benceno con cloruro de aroilo es entre un 10 y un 30 % menor que la del catalizador de Friedel-Crafts: [17]
Nafion-H aumenta las tasas de reacción de protección a través de dihidropirano u o-trialquilsilación de alcoholes, fenol y ácidos carboxílicos. [16]
El nafion puede catalizar un desplazamiento del hidruro 1,2 . [16]
Es posible inmovilizar enzimas dentro del Nafion agrandando los poros con sales lipofílicas . El Nafion mantiene una estructura y un pH que proporcionan un entorno estable para las enzimas. Las aplicaciones incluyen la oxidación catalítica de dinucleótidos de adenina. [16]
El Nafion se ha utilizado en la producción de sensores , con aplicaciones en sensores selectivos de iones, metalizados, ópticos y biosensores . Lo que hace que el Nafion sea especialmente interesante es su demostración en biocompatibilidad . Se ha demostrado que el Nafion es estable en cultivos celulares , así como en el cuerpo humano, y existe una considerable investigación orientada a la producción de sensores de glucosa de mayor sensibilidad . [3]
Las superficies de Nafion muestran una zona de exclusión contra la colonización de bacterias. [18] Además, los recubrimientos capa por capa que comprenden Nafion muestran excelentes propiedades antimicrobianas. [19]
La nave espacial Dragon 2 de SpaceX, apta para uso humano, utiliza membranas de Nafion para deshumidificar el aire de la cabina. Un lado de la membrana está expuesto a la atmósfera de la cabina y el otro al vacío del espacio. Esto da como resultado la deshumidificación, ya que el Nafion es permeable a las moléculas de agua, pero no al aire. Esto ahorra energía y complejidad, ya que no se requiere refrigeración (como se necesita con un deshumidificador de condensación) y el agua extraída se expulsa al espacio sin necesidad de ningún mecanismo adicional. [20]
El Nafion normal se deshidrata (y por lo tanto pierde conductividad protónica) cuando la temperatura es superior a ~80 °C. Esta limitación dificulta el diseño de las celdas de combustible porque es deseable que las temperaturas más altas sean mejores para lograr una mejor eficiencia y tolerancia al CO del catalizador de platino. Se puede incorporar sílice y fosfato de circonio a los canales de agua del Nafion mediante reacciones químicas in situ para aumentar la temperatura de trabajo por encima de los 100 °C. [ cita requerida ]
{{cite journal}}: CS1 maint: bot: estado de URL original desconocido ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace )