En nomenclatura química , la nomenclatura IUPAC de química orgánica es un método para nombrar compuestos químicos orgánicos según lo recomendado [1] [2] por la Unión Internacional de Química Pura y Aplicada (IUPAC). Está publicado en la Nomenclatura de Química Orgánica (informalmente llamado Libro Azul). Idealmente, cada compuesto orgánico posible debería tener un nombre a partir del cual se pueda crear una fórmula estructural inequívoca. También existe una nomenclatura IUPAC de química inorgánica .
Para evitar nombres largos y tediosos en la comunicación normal, en la práctica no siempre se siguen las recomendaciones oficiales de denominación de la IUPAC, excepto cuando es necesario dar una definición absoluta e inequívoca a un compuesto. Los nombres IUPAC a veces pueden ser más simples que los nombres más antiguos, como ocurre con el etanol , en lugar de alcohol etílico. En el caso de moléculas relativamente simples, pueden entenderse más fácilmente que los nombres no sistemáticos, que deben aprenderse o examinarse. Sin embargo, el nombre común o trivial suele ser sustancialmente más corto y claro, por lo que se prefiere. Estos nombres no sistemáticos suelen derivarse de una fuente original del compuesto. Además, los nombres muy largos pueden resultar menos claros que las fórmulas estructurales.
En química, se utilizan varios prefijos , sufijos e infijos para describir el tipo y la posición de los grupos funcionales en el compuesto.
Los pasos para nombrar un compuesto orgánico son: [3]
Los números para ese tipo de cadena lateral se agruparán en orden ascendente y se escribirán antes del nombre de la cadena lateral. Si hay dos cadenas laterales con el mismo carbono alfa , el número se escribirá dos veces. Ejemplo: 2,2,3-trimetil-. Si hay dobles y triples enlaces, se escribe "en" (doble enlace) antes de "yne" (triple enlace). Cuando el grupo funcional principal es un grupo funcional terminal (un grupo que sólo puede existir al final de una cadena, como los grupos formilo y carboxilo), no es necesario numerarlo.
El nombre resultante aparece como:
donde cada "#" representa un número. Es posible que los grupos funcionales secundarios y las cadenas laterales del grupo no tengan el mismo aspecto que se muestra aquí, ya que las cadenas laterales y los grupos funcionales secundarios están ordenados alfabéticamente. Los di- y tri- se han utilizado sólo para mostrar su uso. (di- después de #,#, tri- después de #,#,#, etc.)
Aquí hay una molécula de muestra con los carbonos originales numerados:
Para simplificar, aquí hay una imagen de la misma molécula, donde se eliminan los hidrógenos de la cadena principal y los carbonos se muestran por sus números:
Ahora, siguiendo los pasos anteriores:
El nombre final es (6 E , 13 E ) -18-bromo-12-butil-11-cloro-4,8-dietil-5-hidroxi-15-metoxitricosa-6,13-dien-19-ino-3, 9-diona.
Los alcanos de cadena lineal toman el sufijo " -ano " y tienen el prefijo según el número de átomos de carbono en la cadena, siguiendo reglas estándar. Los primeros son:
Por ejemplo, el alcano más simple es el metano CH 4 y el alcano de nueve carbonos CH 3 (CH 2 ) 7 CH 3 se denomina nonano . Los nombres de los primeros cuatro alcanos se derivaron de metanol , éter , ácido propiónico y ácido butírico , respectivamente. El resto se nombran con un prefijo numérico griego , con la excepción de nonano que tiene un prefijo latino y undecano que tiene prefijos de idiomas mixtos.
Los alcanos cíclicos simplemente tienen el prefijo "ciclo-": por ejemplo, C 4 H 8 es ciclobutano (no debe confundirse con buteno ) y C 6 H 12 es ciclohexano (no debe confundirse con hexeno ).
Los alcanos ramificados se denominan alcanos de cadena lineal con grupos alquilo unidos . Tienen el prefijo un número que indica el carbono al que está unido el grupo, contando desde el final de la cadena del alcano. Por ejemplo, (CH 3 ) 2 CHCH 3 , comúnmente conocido como isobutano , se trata como una cadena de propano con un grupo metilo unido al carbono medio (2) y se le da el nombre sistemático de 2-metilpropano. Sin embargo, aunque se podría utilizar el nombre 2-metilpropano , es más fácil y lógico llamarlo simplemente metilpropano: el grupo metilo no podría aparecer en ninguno de los otros átomos de carbono (eso alargaría la cadena y daría como resultado butano, no propano) y por lo tanto el uso del número "2" es innecesario.
Si hay ambigüedad en la posición del sustituyente, dependiendo de qué extremo de la cadena de alcano se cuente como "1", entonces se elige la numeración de modo que se utilice el número menor. Por ejemplo, (CH 3 ) 2 CHCH 2 CH 3 (isopentano) se denomina 2-metilbutano, no 3-metilbutano.

Si hay varias ramas laterales de un grupo alquilo del mismo tamaño, sus posiciones están separadas por comas y el grupo tiene el prefijo multiplicador dependiendo del número de ramas. Por ejemplo, C(CH 3 ) 4 (neopentano) se denomina 2,2-dimetilpropano. Si hay diferentes grupos, se añaden por orden alfabético, separados por comas o guiones. Se utiliza la cadena de alcano principal más larga posible; por lo tanto, 3-etil-4-metilhexano en lugar de 2,3-dietilpentano, aunque estos describen estructuras equivalentes. Los prefijos di-, tri-, etc. se ignoran a los efectos del orden alfabético de las cadenas laterales (por ejemplo, 3-etil-2,4-dimetilpentano, no 2,4-dimetil-3-etilpentano).
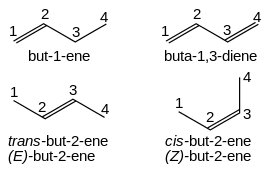
Los alquenos reciben el nombre de su cadena de alcanos original con el sufijo " -eno " y una raíz numérica que indica la posición del carbono con el número más bajo para cada doble enlace en la cadena: CH 2 =CHCH 2 CH 3 es but-1-eno . Los dobles enlaces múltiples toman la forma -dieno, -trieno, etc., y el prefijo de tamaño de la cadena toma una "a" adicional: CH 2 =CHCH=CH 2 es buta-1,3-dieno. Los isómeros cis y trans simples pueden indicarse con el prefijo cis- o trans- : cis -but-2-eno, trans -but-2-eno. Sin embargo, cis- y trans- son descriptores relativos . Es una convención de la IUPAC describir todos los alquenos utilizando descriptores absolutos de Z- (mismo lado) y E- (opuesto) con las reglas de prioridad de Cahn-Ingold-Prelog (ver también notación E-Z ).
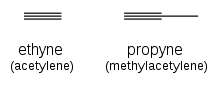
Los alquinos se nombran utilizando el mismo sistema, con el sufijo " -ino " que indica un triple enlace: etino ( acetileno ), propino ( metilacetileno ).

En los haloalcanos y haloarenos ( R-X ), los grupos funcionales halógenos tienen como prefijo la posición de enlace y toman la forma de fluoro, cloro, bromo, yodo, etc., dependiendo del halógeno. Los grupos múltiples son dicloro, tricloro, etc., y los grupos diferentes están ordenados alfabéticamente como antes. Por ejemplo, CHCl 3 ( cloroformo ) es triclorometano. El anestésico halotano ( CF 3 CHBrCl ) es 2-bromo-2-cloro-1,1,1-trifluoroetano.

Los alcoholes ( R−OH ) toman el sufijo " -ol " con un sufijo numérico que indica la posición del enlace: CH 3 CH 2 CH 2 OH es propan-1-ol. Los sufijos -diol , -triol , -tetraol , etc., se utilizan para múltiples grupos −OH : Etilenglicol CH 2 OHCH 2 OH es etano-1,2-diol.

Si hay grupos funcionales de mayor precedencia (consulte el orden de precedencia a continuación), se usa el prefijo "hidroxi" con la posición de enlace: CH 3 CHOHCOOH es ácido 2-hidroxipropanoico.

Los éteres ( R−O−R ) consisten en un átomo de oxígeno entre las dos cadenas de carbono unidas. La más corta de las dos cadenas se convierte en la primera parte del nombre con el sufijo -ano cambiado a -oxi, y la cadena de alcano más larga se convierte en el sufijo del nombre del éter. Así, CH 3 OCH 3 es metoximetano y CH 3 OCH 2 CH 3 es metoxietano ( no etoximetano). Si el oxígeno no está unido al extremo de la cadena de alcano principal, entonces todo el grupo alquilo más éter más corto se trata como una cadena lateral y se le antepone su posición de enlace en la cadena principal. Así, CH3OCH ( CH3 ) 2 es 2-metoxipropano.
Alternativamente, una cadena de éter puede denominarse como un alcano en el que un carbono se reemplaza por un oxígeno, reemplazo indicado por el prefijo "oxa". Por ejemplo, CH 3 OCH 2 CH 3 también podría llamarse 2-oxabutano y un epóxido podría llamarse oxaciclopropano. Este método es especialmente útil cuando ambos grupos unidos al átomo de oxígeno son complejos. [4]
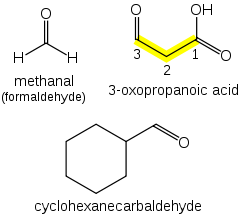
Los aldehídos ( R−CH=O ) toman el sufijo " -al ". Si hay otros grupos funcionales presentes, la cadena se numera de manera que el carbono aldehído esté en la posición "1", a menos que estén presentes grupos funcionales de mayor precedencia.
Si se requiere una forma de prefijo, se utiliza "oxo-" (como para las cetonas), y el número de posición indica el final de una cadena: CHOCH 2 COOH es ácido 3-oxopropanoico. Si el carbono del grupo carbonilo no puede incluirse en la cadena unida (por ejemplo, en el caso de aldehídos cíclicos ), se utiliza el prefijo "formil-" o el sufijo "-carbaldehído": C 6 H 11 CHO es ciclohexanocarbaldehído. Si un aldehído está unido a un benceno y es el grupo funcional principal, el sufijo se convierte en benzaldehído.

En general, las cetonas ( R 2 C=O ) toman el sufijo " -one " (pronunciado own , no won ) con un número de posición sufijado: CH 3 CH 2 CH 2 COCH 3 es pentan-2-ona. Si se utiliza un sufijo de mayor precedencia, se utiliza el prefijo "oxo-": CH 3 CH 2 CH 2 COCH 2 CHO es 3-oxohexanal.

En general, los ácidos carboxílicos ( R−C(=O)OH ) se denominan con el sufijo ácido -oico (etimológicamente una formación posterior del ácido benzoico ). Al igual que con los aldehídos, el grupo funcional carboxilo debe ocupar la posición "1" en la cadena principal y, por lo tanto, no es necesario indicar el localizador. Por ejemplo, CH 3 −CH(OH)−COOH ( ácido láctico ) se denomina ácido 2-hidroxipropanoico sin indicar "1". Algunos nombres tradicionales de los ácidos carboxílicos comunes (como el ácido acético ) se utilizan tan ampliamente que se conservan en la nomenclatura de la IUPAC, [5] aunque también se utilizan nombres sistemáticos como el ácido etanoico. Los ácidos carboxílicos unidos a un anillo de benceno son análogos estructurales del ácido benzoico ( Ph −COOH ) y se denominan uno de sus derivados.
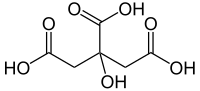
Si hay varios grupos carboxilo en la misma cadena principal, se utilizan prefijos multiplicadores: El ácido malónico , CH 2 (COOH) 2 , se denomina sistemáticamente ácido propanodioico. Alternativamente, se puede utilizar el sufijo "ácido -carboxílico" en lugar de "ácido oico", combinado con un prefijo multiplicador si es necesario; el ácido melítico es ácido bencenohexacarboxílico, por ejemplo. En el último caso, los átomos de carbono de los grupos carboxilo no cuentan como parte de la cadena principal, regla que también se aplica a la forma del prefijo "carboxi-". El ácido cítrico sirve como ejemplo: formalmente se denomina ácido 2-hidroxipropano-1,2,3-tricarboxílico en lugar de ácido 3-carboxi-3-hidroxipentanodioico .

Las sales de ácidos carboxílicos se nombran siguiendo las convenciones habituales de cationes y luego aniones utilizadas para compuestos iónicos tanto en la IUPAC como en los sistemas de nomenclatura común. El nombre del anión carboxilato ( R−C(=O)O − ) se deriva del del ácido original reemplazando el "ácido –oico" que termina con "–oato" o "carboxilato". Por ejemplo, C 6 H 5 CO 2 Na , la sal de sodio del ácido benzoico ( C 6 H 5 COOH ), se llama benzoato de sodio. Cuando un ácido tiene un nombre sistemático y común (como CH 3 COOH , por ejemplo, que se conoce como ácido acético y ácido etanoico), sus sales pueden denominarse a partir de cualquiera de los nombres originales. Por tanto, el CH 3 CO 2 K puede denominarse acetato de potasio o etanoato de potasio. La forma del prefijo es "carboxilato-".
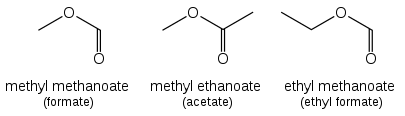
Los ésteres ( R−C(=O)O−R' ) se denominan derivados alquílicos de ácidos carboxílicos. El grupo alquilo (R') se nombra primero. La parte R−C(=O)O luego se nombra como una palabra separada según el nombre del ácido carboxílico, con la terminación cambiada de "-ácido oico" a " -oato " o "-carboxilato". Por ejemplo, CH 3 CH 2 CH 2 CH 2 COOCH 3 es pentanoato de metilo y (CH 3 ) 2 CHCH 2 CH 2 COOCH 2 CH 3 es 4-metilpentanoato de etilo. Para ésteres como el acetato de etilo ( CH 3 COOCH 2 CH 3 ), el formiato de etilo ( HCOOCH 2 CH 3 ) o el ftalato de dimetilo que se basan en ácidos comunes, la IUPAC recomienda el uso de estos nombres establecidos, llamados nombres retenidos. El "-oate" cambia a "-ate". En la figura anterior se muestran algunos ejemplos sencillos, denominados en ambas formas.

Si el grupo alquilo no está unido al final de la cadena, la posición del enlace al grupo éster tiene el sufijo antes de "-ilo": CH 3 CH 2 CH(CH 3 )OOCCH 2 CH 3 puede denominarse butan-2-ilo. propanoato o propionato de butan-2-ilo. [ cita necesaria ] . La forma del prefijo es "oxicabonilo-" con el grupo (R') precedido.

Los grupos acilo se nombran separando el "ácido -ico" del ácido carboxílico correspondiente y reemplazándolo con "-ilo". Por ejemplo, CH 3 CO-R se llama etanoil-R.
Simplemente agregue el nombre del haluro adjunto al final del grupo acilo. Por ejemplo, CH 3 COCl es cloruro de etanoilo. Un sufijo alternativo es "haluro de -carbonilo" en contraposición a "haluro de -oilo". La forma del prefijo es "halocarbonilo-".


Los anhídridos de ácido ( R−C(=O)−O−C(=O)−R ) tienen dos grupos acilo unidos por un átomo de oxígeno. Si ambos grupos acilo son iguales, entonces el nombre del ácido carboxílico con la palabra ácido se reemplaza por la palabra anhídrido y el nombre IUPAC consta de dos palabras. Si los grupos acilo son diferentes, entonces se nombran en orden alfabético de la misma manera, con anhídrido reemplazando al ácido y el nombre IUPAC consta de tres palabras. Por ejemplo, CH3CO - O-OCCH3 se llama anhídrido etanoico y CH3CO - O-OCCH2CH3 se llama anhídrido propanoico etanoico .

Las aminas ( R-NH 2 ) reciben su nombre de la cadena de alcano unida con el sufijo "-amina" (p. ej., CH 3 NH 2 metanamina). Si es necesario, la posición de unión tiene el sufijo: CH 3 CH 2 CH 2 NH 2 propan-1-amina, CH 3 CHNH 2 CH 3 propan-2-amina. La forma del prefijo es "amino-".
Para las aminas secundarias (de la forma R-NH-R ), la cadena de carbono más larga unida al átomo de nitrógeno se convierte en el nombre principal de la amina; la otra cadena tiene el prefijo un grupo alquilo con el prefijo de ubicación indicado como N en cursiva : CH 3 NHCH 2 CH 3 es N -metiletanamina. Las aminas terciarias ( R−NR−R ) se tratan de manera similar: CH 3 CH 2 N (CH 3 )CH 2 CH 2 CH 3 es N -etil- N -metilpropanamina. Nuevamente, los grupos sustituyentes están ordenados alfabéticamente.
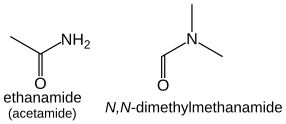
Las amidas ( R−C(=O)NH 2 ) toman el sufijo "-amida" o "-carboxamida" si el carbono del grupo amida no puede incluirse en la cadena principal. La forma del prefijo es "carbamoilo-". por ejemplo , HCONH2 metanamida, CH3 CONH2 etanamida .
Las amidas que tienen sustituyentes adicionales en el nitrógeno se tratan de manera similar al caso de las aminas: están ordenadas alfabéticamente con el prefijo de ubicación N : HCON(CH 3 ) 2 es N , N -dimetilmetanamida, CH 3 CON(CH 3 ) 2 es N , N -dimetiletanamida.

Los nitrilos ( R−C≡N ) se nombran agregando el sufijo "-nitrilo" a la cadena de hidrocarburos más larga (incluido el carbono del grupo ciano). También se puede denominar sustituyendo el "ácido -oico" de sus correspondientes ácidos carboxílicos por "-carbonitrilo". La forma del prefijo es "ciano-". La nomenclatura de clases funcionales IUPAC también se puede utilizar en forma de cianuros de alquilo. Por ejemplo, CH 3 CH 2 CH 2 CH 2 C≡N se llama pentanonitrilo o cianuro de butilo.

Los cicloalcanos y los compuestos aromáticos pueden tratarse como la cadena principal principal del compuesto, en cuyo caso las posiciones de los sustituyentes están numeradas alrededor de la estructura del anillo. Por ejemplo, los tres isómeros del xileno CH 3 C 6 H 4 CH 3 , comúnmente las formas orto , meta y para , son 1,2-dimetilbenceno, 1,3-dimetilbenceno y 1,4-dimetilbenceno. Las estructuras cíclicas también pueden tratarse como grupos funcionales en sí mismos, en cuyo caso toman el prefijo "cicloalquilo - " (por ejemplo, "ciclohexilo-") o, para el benceno, "fenil-".
El esquema de nomenclatura de la IUPAC se vuelve rápidamente más elaborado para estructuras cíclicas más complejas, con notación para compuestos que contienen anillos unidos y muchos nombres comunes, como fenol , aceptados como nombres básicos para compuestos derivados de ellos.
Cuando los compuestos contienen más de un grupo funcional, el orden de precedencia determina qué grupos se nombran con formas de prefijo o sufijo. La siguiente tabla muestra los grupos comunes en orden decreciente de precedencia. El grupo de mayor prioridad toma el sufijo, y todos los demás toman la forma de prefijo. Sin embargo, los enlaces dobles y triples sólo toman forma de sufijo (-en y -yn) y se utilizan con otros sufijos.
Los sustituyentes prefijados están ordenados alfabéticamente (excluyendo cualquier modificador como di, tri, etc.), por ejemplo, clorofluorometano, no fluoroclorometano. Si hay varios grupos funcionales del mismo tipo, ya sea con prefijo o sufijo, los números de posición se ordenan numéricamente (por lo tanto, etano-1,2-diol, no etano-2,1-diol). El indicador de posición N para aminas y amidas viene antes de "1", por ejemplo, CH3CH (CH3 ) CH2NH ( CH3 ) es N , 2-dimetilpropanamina.
* Nota : Estos sufijos, en los que el átomo de carbono se cuenta como parte de la cadena anterior, son los más utilizados. Consulte los artículos de grupos funcionales individuales para obtener más detalles.
El orden de los grupos funcionales restantes sólo es necesario para el benceno sustituido y, por tanto, no se menciona aquí. [ se necesita aclaración ]
La nomenclatura común utiliza los nombres más antiguos para algunos compuestos orgánicos en lugar de utilizar los prefijos anteriores para el esqueleto de carbono. El patrón se puede ver a continuación.
Los nombres comunes para las cetonas se pueden derivar nombrando los dos grupos alquilo o arilo unidos al grupo carbonilo como palabras separadas seguidas de la palabra cetona .
Los primeros tres nombres que se muestran arriba todavía se consideran nombres IUPAC aceptables.
El nombre común de un aldehído se deriva del nombre común del ácido carboxílico correspondiente eliminando la palabra ácido y cambiando el sufijo de -ic o -oic a -aldehído.
La nomenclatura IUPAC también proporciona reglas para nombrar iones .
Hydron es un término genérico para catión de hidrógeno; Los protones, deuterones y tritones son todos hidrones. Sin embargo, los hidrones no se encuentran en los isótopos más pesados.
Los cationes simples formados al agregar un hidrón a un hidruro de un halógeno, calcógeno o pnictógeno se nombran agregando el sufijo "-onio" a la raíz del elemento: H 4 N + es amonio, H 3 O + es oxonio y H2F+ es fluoronio. . Se adoptó amonio en lugar de nitronio, que comúnmente se refiere a NO.+2.
Si el centro catiónico del hidruro no es un halógeno, calcógeno o pnictógeno, se añade el sufijo "-io" al nombre del hidruro neutro después de eliminar la "e" final. H 5 C + es metanio, HO−(O + )H 2 es dioxidanio (HO-OH es dioxidano) y H 2 N − (N + )H 3 es diazanio ( H 2 N−NH 2 es diazano).
Los cationes anteriores, excepto el metanio, no son, estrictamente hablando, orgánicos, ya que no contienen carbono. Sin embargo, muchos cationes orgánicos se obtienen sustituyendo un hidrógeno por otro elemento o algún grupo funcional.
El nombre de cada sustitución va precedido del nombre del catión hidruro. Si se producen muchas sustituciones por el mismo grupo funcional, entonces el número se indica anteponiendo "di-", "tri-" como en la halogenación. (CH 3 ) 3 O + es trimetiloxonio. CH3F3N + es trifluorometilamonio . _ _
{{cite book}}: CS1 maint: others (link)