
Un silicato es cualquier miembro de una familia de aniones poliatómicos que consisten en silicio y oxígeno , generalmente con la fórmula general [SiO(4-2 x )−
4− x]
norte, donde 0 ≤ x < 2 . La familia incluye ortosilicato SiO4−4( x = 0 ), metasilicato SiO2−3( x = 1 ), y pirosilicato Si 2 O6−7( x = 0,5 , n = 2 ). El nombre también se utiliza para cualquier sal de tales aniones, como el metasilicato de sodio ; o cualquier éster que contenga el grupo químico correspondiente , como el ortosilicato de tetrametilo . [1] El nombre "silicato" a veces se extiende a cualquier anión que contenga silicio, incluso si no se ajusta a la fórmula general o contiene otros átomos además del oxígeno; como el hexafluorosilicato [SiF 6 ] 2− . Lo más común es que los silicatos se encuentren como minerales de silicato .
Para diversas necesidades manufactureras, tecnológicas y artísticas, los silicatos son materiales versátiles, tanto naturales (como el granito , la grava y el granate ) como artificiales (como el cemento Portland , la cerámica , el vidrio y el vidrio soluble ).
En la mayoría de los silicatos, el átomo de silicio ocupa el centro de un tetraedro idealizado cuyos vértices son cuatro átomos de oxígeno, conectados a él por enlaces covalentes simples según la regla del octeto . [1] Los átomos de oxígeno, que tienen cierta carga negativa, se unen a otros cationes (M n+ ). Este enlace Si-OMO-Si es fuerte y rígido, propiedades que se manifiestan en los silicatos similares a rocas. Los silicatos se pueden clasificar según la longitud y la reticulación de los aniones de silicato.
Los aniones ortosilicatos aislados tienen la fórmula SiO4−
4Un mineral común en este grupo es el olivino ( (Mg,Fe) 2 SiO 4 ).
Dos o más átomos de silicio pueden compartir átomos de oxígeno de diversas maneras, para formar aniones más complejos, como el pirosilicato Si
2Oh6−
7.

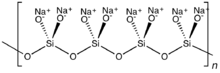
Con dos óxidos compartidos unidos a cada silicio, pueden resultar estructuras cíclicas o poliméricas. El anillo de metasilicato cíclico Si
6Oh12−
18es un hexámero de SiO 3 2- . Los aniones de silicato polimérico también pueden existir como cadenas largas.
En los silicatos monocatenarios, que son un tipo de inosilicato , los tetraedros se unen para formar una cadena al compartir dos átomos de oxígeno cada uno. Un mineral común en este grupo es el piroxeno .

Los silicatos de doble cadena, la otra categoría de inosilicatos, se forman cuando los tetraedros forman una cadena doble (no siempre, pero en su mayoría) al compartir dos o tres átomos de oxígeno cada uno. Los minerales comunes de este grupo son los anfíboles .

En este grupo, conocido como filosilicatos , los tetraedros comparten tres átomos de oxígeno cada uno y, a su vez, se unen para formar láminas bidimensionales. Esta estructura hace que los minerales de este grupo tengan un único plano de clivaje fuerte. Las micas pertenecen a este grupo. Tanto la moscovita como la biotita tienen capas muy débiles que se pueden desprender en láminas.
En un silicato de estructura, conocido como tectosilicato , cada tetraedro comparte los cuatro átomos de oxígeno con sus vecinos, formando una estructura tridimensional. El cuarzo y los feldespatos pertenecen a este grupo.
Aunque el tetraedro es una geometría de coordinación común para los compuestos de silicio (IV), el silicio también puede presentarse con números de coordinación más altos. Por ejemplo, en el anión hexafluorosilicato SiF2−
6El átomo de silicio está rodeado por seis átomos de flúor en una disposición octaédrica . Esta estructura también se observa en el anión hexahidroxisilicato Si(OH)2−
6que se encuentra en la taumasita , un mineral que se encuentra raramente en la naturaleza pero que a veces se observa entre otros hidratos de silicato de calcio formados artificialmente en estructuras de cemento y hormigón sometidas a un severo ataque de sulfatos en suelos arcillosos que contienen pirita oxidada . [2] [3] [4] [5] [6]
A presiones muy altas, como las que existen en la mayor parte de la corteza terrestre, incluso el SiO 2 adopta la geometría octaédrica de seis coordenadas en el mineral stishovita , un polimorfo denso de sílice que se encuentra en el manto inferior de la Tierra y que también se forma por el choque durante los impactos de meteoritos .
Los silicatos con cationes alcalinos y aniones pequeños o en forma de cadena, como el orto y el metasilicato de sodio , son bastante solubles en agua. Forman varios hidratos sólidos cuando se cristalizan a partir de una solución. Los silicatos de sodio solubles y sus mezclas, conocidos como vidrio soluble , son importantes productos químicos industriales y domésticos. Los silicatos de cationes no alcalinos, o con aniones poliméricos en láminas y tridimensionales, generalmente tienen una solubilidad insignificante en agua en condiciones normales.
Los silicatos son generalmente inertes químicamente, por lo que son minerales comunes. Su resiliencia también recomienda su uso como material de construcción.
Cuando se tratan con óxidos de calcio y agua, los minerales de silicato forman el cemento Portland .
Los equilibrios que implican la hidrólisis de minerales de silicato son difíciles de estudiar. El principal desafío es la muy baja solubilidad del SiO 4 4- y sus diversas formas protonadas. Dichos equilibrios son relevantes para los procesos que ocurren en escalas de tiempo geológicas. [7] [8] Algunas plantas excretan ligandos que disuelven los silicatos, un paso en la biomineralización .
Los aniones de silicato en solución reaccionan con los aniones de molibdato , lo que produce complejos de silicomolibdato de color amarillo. En una preparación típica, se descubrió que el ortosilicato monomérico reaccionaba completamente en 75 segundos; el pirosilicato dimérico en 10 minutos; y los oligómeros superiores en un tiempo considerablemente más largo. En particular, la reacción no se observa con suspensiones de sílice coloidal . [8]
La naturaleza de los silicatos solubles es relevante para comprender la biomineralización y la síntesis de aluminosilicatos , como los catalizadores de importancia industrial llamados zeolitas . [7] Junto con los aniones de aluminato , los aniones de silicato solubles también juegan un papel importante en el mecanismo de polimerización de los geopolímeros . Los geopolímeros son aluminosilicatos amorfos cuya producción requiere menos energía que la del cemento Portland ordinario . Por lo tanto, los cementos geopoliméricos podrían contribuir a limitar las emisiones de CO 2 en la atmósfera de la Tierra y el calentamiento global causado por este gas de efecto invernadero .