En química, el ortosilicato es el anión SiO4−
4, o cualquiera de sus sales y ésteres . Es uno de los aniones de silicato . A veces se le llama anión o grupo tetróxido de silicio . [1]
Las sales de ortosilicato, como el ortosilicato de sodio , son estables y se encuentran ampliamente presentes en la naturaleza como minerales de silicato , siendo la característica definitoria de los nesosilicatos . [2] El olivino , un ortosilicato de magnesio o hierro (II), es el mineral más abundante en el manto superior .
El anión ortosilicato es una base fuerte , la base conjugada del extremadamente débil ácido ortosilícico H
4SiO
4(p K a2 = 13,2 a 25 °C). Este equilibrio es difícil de estudiar ya que el ácido tiende a descomponerse en un condensado de sílice hidratado . [3]
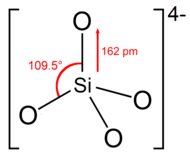
El ion o grupo ortosilicato tiene forma tetraédrica , con un átomo de silicio rodeado por cuatro átomos de oxígeno.
En el anión, cada oxígeno lleva una carga negativa unitaria. [4] El enlace Si-O tiene una longitud de 162 pm. [5]
En compuestos orgánicos como el ortosilicato de tetrametilo , cada oxígeno es formalmente neutro y está conectado al resto de la molécula mediante un solo enlace covalente .
El ortosilicato de bario dopado con europio (Ba 2 SiO 4 ) es un fósforo común que se utiliza en los diodos emisores de luz (LED) verdes. El fósforo para los LED azules se puede fabricar con ortosilicato de bario dopado con estroncio . [6] El ortosilicato de bario es una de las principales causas de envenenamiento de los cátodos en los tubos de vacío . [7]
Aunque es muy importante en la química inorgánica y la geoquímica, el ion ortosilicato rara vez se ve en la química orgánica. Sin embargo, dos compuestos de silicato se utilizan en la síntesis orgánica : el ortosilicato de tetraetilo o TEOS se utiliza para unir polímeros y es especialmente importante en la fabricación de aerogeles. El ortosilicato de tetrametilo o TMOS se utiliza como alternativa al TEOS y también tiene otros usos como reactivo. El TEOS se prefiere al TMOS ya que el TMOS se descompone para producir altas concentraciones de metanol tóxico . La inhalación de TMOS puede provocar una acumulación tóxica de sílice en los pulmones.