La química combinatoria comprende métodos de síntesis química que permiten preparar una gran cantidad (decenas, miles o incluso millones) de compuestos en un solo proceso. Estas bibliotecas de compuestos pueden estar formadas por mezclas, conjuntos de compuestos individuales o estructuras químicas generadas por software informático. [1] La química combinatoria se puede utilizar para la síntesis de moléculas pequeñas y de péptidos.
Las estrategias que permiten identificar componentes útiles de las bibliotecas también forman parte de la química combinatoria. Los métodos utilizados en la química combinatoria también se aplican fuera de la química.
El principio básico de la química combinatoria es preparar bibliotecas de un gran número de compuestos e identificar aquellos que son útiles como posibles fármacos o agroquímicos. Esto se basa en un cribado de alto rendimiento que sea capaz de evaluar el resultado a una escala suficiente. [2]
Aunque la química combinatoria ha sido realmente adoptada por la industria recién a partir de los años 1990, [3] sus raíces se remontan a los años 1960, cuando un investigador de la Universidad Rockefeller , Bruce Merrifield , comenzó a investigar la síntesis en fase sólida de péptidos . La síntesis de péptidos de manera combinatoria conduce rápidamente a un gran número de moléculas. El uso de los veinte aminoácidos naturales , por ejemplo, en un tripéptido crea 8.000 (20 3 ) posibilidades. Más tarde se introdujeron los métodos en fase sólida para moléculas pequeñas y Furka ideó un enfoque de "división y mezcla" [2] [4]
En su forma moderna, la química combinatoria probablemente ha tenido su mayor impacto en la industria farmacéutica . [5] Los investigadores que intentan optimizar el perfil de actividad de un compuesto crean una "biblioteca" de muchos compuestos diferentes pero relacionados. [6] [7] Los avances en robótica han llevado a un enfoque industrial para la síntesis combinatoria, permitiendo a las empresas producir rutinariamente más de 100.000 compuestos nuevos y únicos por año. [8]
Para manejar la gran cantidad de posibilidades estructurales, los investigadores a menudo crean una "biblioteca virtual", una enumeración computacional de todas las estructuras posibles de un farmacóforo dado con todos los reactivos disponibles . [9] Dicha biblioteca puede constar de miles a millones de compuestos "virtuales". El investigador seleccionará un subconjunto de la "biblioteca virtual" para la síntesis real, basándose en varios cálculos y criterios (ver ADME , química computacional y QSAR ).

La síntesis de combinación de división y mezcla (split and pool) [10] [11] se basa en la síntesis en fase sólida desarrollada por Merrifield [12] . Si se sintetiza una biblioteca de péptidos combinatoria utilizando 20 aminoácidos (u otros tipos de bloques de construcción), el soporte sólido en forma de perlas se divide en 20 porciones iguales. A esto le sigue el acoplamiento de un aminoácido diferente a cada porción. El tercer paso es la mezcla de todas las porciones. Estos tres pasos comprenden un ciclo. La elongación de las cadenas de péptidos se puede lograr simplemente repitiendo los pasos del ciclo.

El procedimiento se ilustra mediante la síntesis de una biblioteca de dipéptidos que utiliza los mismos tres aminoácidos como bloques de construcción en ambos ciclos. Cada componente de esta biblioteca contiene dos aminoácidos dispuestos en diferentes órdenes. Los aminoácidos utilizados en los acoplamientos están representados por círculos amarillos, azules y rojos en la figura. Las flechas divergentes muestran la división de la resina de soporte sólida (círculos verdes) en porciones iguales, las flechas verticales significan acoplamiento y las flechas convergentes representan la mezcla y homogeneización de las porciones del soporte.
La figura muestra que en los dos ciclos sintéticos se forman 9 dipéptidos. En el tercer y cuarto ciclo se formarían 27 tripéptidos y 81 tetrapéptidos, respectivamente.
La "síntesis de mezcla dividida" tiene varias características destacadas:
En 1990, tres grupos describieron métodos para preparar bibliotecas de péptidos mediante métodos biológicos [13] [14] [15] y un año después, Fodor et al. publicaron un método notable para la síntesis de matrices de péptidos en pequeños portaobjetos de vidrio. [16]
Mario Geysen y sus colegas desarrollaron un método de "síntesis paralela" para la preparación de matrices de péptidos. [17] Sintetizaron 96 péptidos en varillas de plástico (pins) recubiertas en sus extremos con el soporte sólido. Los pins se sumergieron en la solución de reactivos colocados en los pocillos de una placa de microtitulación . El método se aplica ampliamente, particularmente mediante el uso de sintetizadores paralelos automáticos. Aunque el método paralelo es mucho más lento que el combinatorio real, su ventaja es que se sabe exactamente qué péptido u otro compuesto se forma en cada pin.
Se desarrollaron otros procedimientos para combinar las ventajas de la síntesis en paralelo y de la mezcla dividida. En el método descrito por dos grupos [18] [19], el soporte sólido se encerró en cápsulas de plástico permeables junto con una etiqueta de radiofrecuencia que contenía el código del compuesto que se iba a formar en la cápsula. El procedimiento se llevó a cabo de manera similar al método de mezcla dividida. Sin embargo, en la etapa de división, las cápsulas se distribuyeron entre los recipientes de reacción de acuerdo con los códigos leídos de las etiquetas de radiofrecuencia de las cápsulas.
Furka et al. [20] desarrollaron un método diferente para el mismo propósito, denominado "síntesis de cuerdas". En este método, las cápsulas no llevan ningún código. Se colocan ensartadas como las perlas de un collar y se colocan en los recipientes de reacción en forma de cuerdas. La identidad de las cápsulas, así como su contenido, se almacenan por su posición ocupada en las cuerdas. Después de cada paso de acoplamiento, las cápsulas se redistribuyen entre nuevas cuerdas de acuerdo con reglas definidas.
En el proceso de descubrimiento de fármacos, la síntesis y evaluación biológica de pequeñas moléculas de interés ha sido típicamente un proceso largo y laborioso. La química combinatoria ha surgido en las últimas décadas como un enfoque para sintetizar de manera rápida y eficiente un gran número de posibles candidatos a fármacos de moléculas pequeñas. En una síntesis típica, solo se produce una única molécula objetivo al final de un esquema sintético, y cada paso de una síntesis produce solo un único producto. En una síntesis combinatoria , cuando se utiliza solo un único material de partida, es posible sintetizar una gran biblioteca de moléculas utilizando condiciones de reacción idénticas que luego se pueden examinar para determinar su actividad biológica . Luego, este grupo de productos se divide en tres porciones iguales que contienen cada uno de los tres productos, y luego cada uno de los tres grupos individuales se hace reaccionar con otra unidad de reactivo B, C o D, produciendo 9 compuestos únicos a partir de los 3 anteriores. Luego, este proceso se repite hasta que se agrega la cantidad deseada de bloques de construcción, lo que genera muchos compuestos. Al sintetizar una biblioteca de compuestos mediante una síntesis de varios pasos, se deben emplear métodos de reacción eficientes y, si se utilizan métodos de purificación tradicionales después de cada paso de reacción, los rendimientos y la eficiencia se verán afectados.
La síntesis en fase sólida ofrece soluciones potenciales para obviar la necesidad de los pasos típicos de extinción y purificación que se utilizan a menudo en la química sintética. En general, una molécula de partida se adhiere a un soporte sólido (normalmente un polímero insoluble), luego se realizan reacciones adicionales y el producto final se purifica y luego se escinde del soporte sólido. Dado que las moléculas de interés están unidas a un soporte sólido, es posible reducir la purificación después de cada reacción a un solo paso de filtración/lavado, eliminando la necesidad de los tediosos pasos de extracción líquido-líquido y evaporación del disolvente que implica la mayoría de la química sintética. Además, al utilizar reactivos heterogéneos, se pueden utilizar reactivos en exceso para llevar a cabo reacciones lentas hasta su finalización, lo que puede mejorar aún más los rendimientos. Los reactivos en exceso se pueden eliminar simplemente por lavado sin necesidad de pasos de purificación adicionales, como la cromatografía .

A lo largo de los años, se han desarrollado diversos métodos para perfeccionar el uso de la síntesis orgánica en fase sólida en la química combinatoria, incluidos los esfuerzos por aumentar la facilidad de síntesis y purificación, así como los métodos no tradicionales para caracterizar los productos intermedios. Aunque la mayoría de los ejemplos descritos aquí emplearán medios de reacción heterogéneos en cada paso de reacción, Booth y Hodges proporcionan un ejemplo temprano del uso de reactivos soportados en sólidos solo durante el paso de purificación de las síntesis tradicionales en fase de solución. [21] En su opinión, la química en fase de solución ofrece las ventajas de evitar las reacciones de unión y escisión necesarias para anclar y eliminar moléculas a las resinas, así como de eliminar la necesidad de recrear análogos en fase sólida de reacciones en fase de solución establecidas.
El paso de purificación único al final de una síntesis permite eliminar una o más impurezas, suponiendo que se conoce la estructura química de la impureza en cuestión. Si bien el uso de reactivos con soporte sólido simplifica en gran medida la síntesis de compuestos, muchas síntesis combinatorias requieren múltiples pasos, cada uno de los cuales aún requiere alguna forma de purificación. Armstrong, et al. describen un método de un solo recipiente para generar bibliotecas combinatorias, llamadas condensaciones de múltiples componentes (MCC). [22] En este esquema, tres o más reactivos reaccionan de manera que cada reactivo se incorpora al producto final en un solo paso, eliminando la necesidad de una síntesis de múltiples pasos que involucra muchos pasos de purificación. En las MCC, no se requiere deconvolución para determinar qué compuestos son biológicamente activos porque cada síntesis en una matriz tiene solo un único producto, por lo que la identidad del compuesto debe conocerse de manera inequívoca.
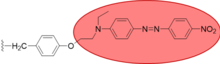
En otra síntesis de matriz, Still generó una gran biblioteca de oligopéptidos mediante síntesis dividida. [23] El inconveniente de producir muchos miles de compuestos es que es difícil determinar la estructura de los compuestos formados. Su solución es utilizar etiquetas moleculares, donde una pequeña cantidad (1 pmol/perla) de un tinte se adhiere a las perlas, y la identidad de una determinada perla se puede determinar analizando qué etiquetas están presentes en la perla. A pesar de lo fácil que es la adhesión de etiquetas para la identificación de receptores, sería bastante imposible examinar individualmente cada compuesto para determinar su capacidad de unión al receptor, por lo que se adhirió un tinte a cada receptor, de modo que solo aquellos receptores que se unen a su sustrato producen un cambio de color.
Cuando es necesario realizar muchas reacciones en una matriz (como las 96 reacciones descritas en una de las matrices MCC de Armstrong), algunos de los aspectos más tediosos de la síntesis se pueden automatizar para mejorar la eficiencia. Este trabajo, el "método DIVERSOMER", fue iniciado en Parke-Davis a principios de la década de 1990 para realizar hasta 40 reacciones químicas en paralelo. Estos esfuerzos condujeron al primer equipo disponible comercialmente para la química combinatoria (el sintetizador Diversomer que fue vendido por Chemglass) y al primer uso de robótica de manipulación de líquidos dentro de un laboratorio de química. [24] [25] Este método utiliza un dispositivo que automatiza los ciclos de carga y lavado de resina, así como el monitoreo y purificación del ciclo de reacción, y demuestra la viabilidad de su método y aparato al usarlo para sintetizar una variedad de clases de moléculas, como hidantoínas y benzodiazepinas , ejecutando 8 o 40 reacciones individuales en paralelo. Este y varios otros esfuerzos pioneros en química combinatoria fueron presentados como artículos "clásicos" en el campo en 1999. [26]
A menudo, no es posible utilizar equipos costosos, y Schwabacher et al. describen un método simple para combinar la síntesis paralela de miembros de la biblioteca y la evaluación de bibliotecas completas de compuestos. [27] En su método, un hilo dividido en diferentes regiones se enrolla alrededor de un cilindro, donde luego se acopla un reactivo diferente a cada región que contiene solo una especie. Luego, el hilo se vuelve a dividir y se enrolla alrededor de un cilindro de un tamaño diferente, y luego se repite este proceso. La belleza de este método es que la identidad de cada producto se puede conocer simplemente por su ubicación a lo largo del hilo, y la actividad biológica correspondiente se identifica mediante la transformación de Fourier de las señales de fluorescencia.
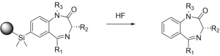
En la mayoría de las síntesis descritas aquí, es necesario unir y retirar el reactivo de partida a/de un soporte sólido. Esto puede conducir a la generación de un grupo hidroxilo, que puede afectar potencialmente la actividad biológica de un compuesto objetivo. Ellman utiliza soportes de fase sólida en un esquema de síntesis de múltiples pasos para obtener 192 derivados individuales de 1,4-benzodiazepina, que son agentes terapéuticos bien conocidos. [28] Para eliminar la posibilidad de una posible interferencia del grupo hidroxilo, se utiliza un método novedoso que utiliza la química sililo-arilo para unir las moléculas al soporte sólido que se escinde del soporte y no deja rastro del enlazador.

Al anclar una molécula a un soporte sólido, los intermediarios no se pueden aislar entre sí sin escindir la molécula de la resina. Dado que muchas de las técnicas de caracterización tradicionales utilizadas para rastrear el progreso de la reacción y confirmar la estructura del producto se basan en soluciones, se deben utilizar técnicas diferentes. La espectroscopia de RMN de 13 C en fase de gel, la espectrometría de masas MALDI y la espectroscopia IR se han utilizado para confirmar la estructura y monitorear el progreso de las reacciones en fase sólida. [29] Gordon et al., describen varios estudios de caso que utilizan iminas y fosfonatos de peptidilo para generar bibliotecas combinatorias de moléculas pequeñas. [29] Para generar la biblioteca de iminas, un aminoácido atado a una resina se hace reaccionar en presencia de un aldehído. Los autores demuestran el uso de la espectroscopia de RMN de 13 C en fase de gel rápida y la espectroscopia de RMN de 1 H con giro de ángulo mágico para monitorear el progreso de las reacciones y demostraron que la mayoría de las iminas se podían formar en tan solo 10 minutos a temperatura ambiente cuando se usaba ortoformiato de trimetilo como disolvente. Las iminas formadas se derivatizaron luego para generar 4-tiazolidinonas, B-lactamas y pirrolidinas.
El uso de soportes en fase sólida simplifica enormemente la síntesis de grandes bibliotecas combinatorias de compuestos. Esto se hace anclando un material de partida a un soporte sólido y luego ejecutando reacciones posteriores hasta que se crea una biblioteca lo suficientemente grande, después de lo cual los productos se separan del soporte. El uso de la purificación en fase sólida también se ha demostrado para su uso en esquemas de síntesis en fase de solución junto con técnicas estándar de purificación por extracción líquido-líquido.
Las bibliotecas combinatorias son mezclas especiales de compuestos químicos de moléculas pequeñas que se sintetizan en un único proceso paso a paso. Se diferencian de la recopilación de compuestos individuales y de las series de compuestos preparados mediante síntesis paralela. Una característica importante es que se utilizan mezclas en su síntesis. El uso de mezclas garantiza la altísima eficiencia del proceso. Ambos reactivos pueden ser mezclas y, en este caso, el procedimiento sería aún más eficiente. Sin embargo, por razones prácticas, es aconsejable utilizar el método de mezcla dividida en el que una de las dos mezclas se sustituye por bloques de construcción (BB) individuales. Las mezclas son tan importantes que no existen bibliotecas combinatorias sin el uso de mezclas en la síntesis, y si se utiliza una mezcla en un proceso, inevitablemente se forma una biblioteca combinatoria. La síntesis de mezcla dividida se realiza normalmente utilizando un soporte sólido, pero también es posible aplicarla en solución. Dado que las estructuras de los componentes son desconocidas, es necesario utilizar métodos de deconvolución en el cribado. Una de las características más importantes de las bibliotecas combinatorias es que se puede cribar toda la mezcla en un único proceso. Esto hace que estas bibliotecas sean muy útiles en la investigación farmacéutica. También se pueden sintetizar bibliotecas parciales de bibliotecas combinatorias completas. Algunas de ellas se pueden utilizar en la deconvolución [30].
Si las moléculas sintetizadas de una biblioteca combinatoria se separan del soporte sólido, se forma una mezcla soluble. En dicha solución, se pueden encontrar millones de compuestos diferentes. Cuando se desarrolló este método sintético, al principio parecía imposible identificar las moléculas y encontrar moléculas con propiedades útiles. Sin embargo, se habían desarrollado estrategias para la identificación de los componentes útiles para resolver el problema. Todas estas estrategias se basan en la síntesis y prueba de bibliotecas parciales. Furka ideó una estrategia iterativa temprana en 1982. [4] El método fue publicado posteriormente de forma independiente por Erb et al. bajo el nombre de "Deconvolución recursiva" [31].
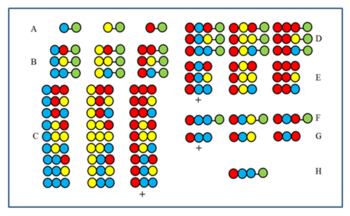
El método se hace comprensible mediante la figura. Se sintetiza una biblioteca de péptidos de 27 miembros a partir de tres aminoácidos. Después del primer (A) y segundo (B) ciclos, las muestras se reservaron antes de mezclarlas. Los productos del tercer ciclo (C) se escinden antes de mezclarlos y luego se prueban para determinar su actividad. Supongamos que el grupo marcado con el signo + está activo. Todos los miembros tienen el aminoácido rojo en la última posición de acoplamiento (CP). En consecuencia, el miembro activo también tiene el aminoácido rojo en el último CP. Luego, el aminoácido rojo se acopla a las tres muestras reservadas después del segundo ciclo (B) para obtener las muestras D. Después de la escisión, se forman las tres muestras E. Si después de la prueba, la muestra marcada con + es la activa, muestra que el aminoácido azul ocupa el segundo CP en el componente activo. Luego, a las tres muestras A, primero se acopla el aminoácido azul y luego el rojo (F) y luego se prueba nuevamente después de la escisión (G). Si el componente + demuestra ser activo, se determina la secuencia del componente activo y se muestra en H.
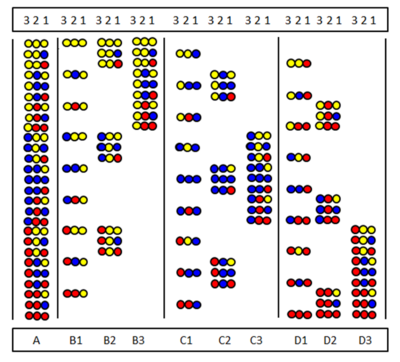
El escaneo posicional fue introducido independientemente por Furka et al. [32] y Pinilla et al. [33]. El método se basa en la síntesis y prueba de series de subbibliotecas, en las que una determinada posición de secuencia está ocupada por el mismo aminoácido. La figura muestra las nueve subbibliotecas (B1-D3) de una biblioteca completa de trímeros peptídicos (A) formada por tres aminoácidos. En las subbibliotecas hay una posición que está ocupada por el mismo aminoácido en todos los componentes. En la síntesis de una subbiblioteca, el soporte no se divide y solo se acopla un aminoácido a toda la muestra. Como resultado, una posición está realmente ocupada por el mismo aminoácido en todos los componentes. Por ejemplo, en la subbiblioteca B2, la posición 2 está ocupada por el aminoácido "amarillo" en todos los nueve componentes. Si en una prueba de detección esta subbiblioteca da una respuesta positiva, significa que la posición 2 en el péptido activo también está ocupada por el aminoácido "amarillo". La secuencia de aminoácidos se puede determinar probando las nueve subbibliotecas (o en ocasiones menos).
En las bibliotecas de omisión [34] [35], falta un determinado aminoácido en todos los péptidos de la mezcla. La figura muestra la biblioteca completa y las tres bibliotecas de omisión. En la parte superior se muestran los aminoácidos omitidos. Si la biblioteca de omisión da un resultado negativo, el aminoácido omitido está presente en el componente activo.
Si los péptidos no se separan del soporte sólido, se trata de una mezcla de perlas, cada una de las cuales contiene un único péptido. Smith y sus colegas [36] demostraron anteriormente que los péptidos también se podían probar en forma anclada. Este enfoque también se utilizó en la selección de bibliotecas de péptidos. La biblioteca de péptidos anclados se probó con una proteína diana disuelta. Se seleccionaron las perlas a las que estaba unida la proteína, se retiró la proteína de la perla y luego se identificó el péptido anclado mediante secuenciación. Taylor y Morken [37] siguieron un enfoque algo diferente. Utilizaron termografía infrarroja para identificar catalizadores en bibliotecas ancladas sin péptidos. El método se basa en el calor que se desarrolla en las perlas que contienen un catalizador cuando la biblioteca anclada se sumerge en una solución de un sustrato. Cuando se examinan las perlas a través de un microscopio infrarrojo, las perlas que contienen el catalizador aparecen como puntos brillantes y se pueden distinguir.
Si tratamos con una biblioteca de bibliotecas orgánicas no peptídicas, no es tan sencillo determinar la identidad del contenido de una perla como en el caso de una peptídica. Para sortear esta dificultad se han desarrollado métodos para unir a las perlas, en paralelo a la síntesis de la biblioteca, moléculas que codifican la estructura del compuesto formado en la perla. Ohlmeyer y sus colegas publicaron un método de codificación binaria [38] Utilizaron mezclas de 18 moléculas de marcado que, tras escindirlas de las perlas, podían identificarse mediante cromatografía de gases por captura de electrones. Sarkar et al. describieron oligómeros quirales de amidas pentenoicas (COPA) que pueden utilizarse para construir bibliotecas OBOC codificadas en masa. [39] Kerr et al. introdujeron un método de codificación innovador [40] Se unió a las perlas un enlazador bifuncional extraíble protegido ortogonalmente. Un extremo del enlazador se utilizó para unir los bloques de construcción no naturales de la biblioteca mientras que al otro extremo se unieron tripletes de aminoácidos codificantes. Los bloques de construcción eran aminoácidos no naturales y la serie de sus tripletes de aminoácidos codificantes podía determinarse por degradación de Edman. El aspecto importante de este tipo de codificación era la posibilidad de escindir de las perlas los miembros de la biblioteca junto con sus etiquetas de codificación adjuntas formando una biblioteca soluble. El mismo enfoque fue utilizado por Nikolajev et al. para codificar con péptidos. [41] En 1992, Brenner y Lerner introdujeron secuencias de ADN para codificar las perlas del soporte sólido que demostraron ser el método de codificación más exitoso. [42] Nielsen, Brenner y Janda también utilizaron el enfoque de Kerr para implementar la codificación de ADN [43] En el último período de tiempo hubo avances importantes en la secuenciación de ADN. Las técnicas de próxima generación hacen posible secuenciar una gran cantidad de muestras en paralelo, lo que es muy importante en la selección de bibliotecas codificadas por ADN. Hubo otra innovación que contribuyó al éxito de la codificación de ADN. En 2000, Halpin y Harbury omitieron el soporte sólido en la síntesis por división y mezcla de las bibliotecas combinatorias codificadas por ADN y lo reemplazaron por los oligómeros de ADN codificantes. En la síntesis por división y mezcla en fase sólida, el número de componentes de las bibliotecas no puede superar el número de perlas del soporte. Gracias al novedoso enfoque de los autores, se eliminó esta restricción y se hizo posible preparar nuevos compuestos en un número prácticamente ilimitado. [44] La empresa danesa Nuevolution, por ejemplo, sintetizó una biblioteca codificada por ADN que contenía ¡40 billones! de componentes [45]Las bibliotecas codificadas por ADN son solubles, lo que permite aplicar la unión por afinidad de manera eficiente en el cribado. Algunos autores aplican el DEL para la acromim de bibliotecas combinatorias codificadas por ADN, otros utilizan DECL. Este último parece mejor ya que en este nombre se expresa claramente la naturaleza combinatoria de estas bibliotecas. Se han introducido y descrito varios tipos de bibliotecas combinatorias codificadas por ADN en la primera década del presente milenio. Estas bibliotecas se aplican con mucho éxito en la investigación de fármacos.
Los detalles sobre su síntesis y aplicación se encuentran en la página Biblioteca química codificada por ADN . Las bibliotecas combinatorias solubles codificadas por ADN también tienen desventajas. En primer lugar, se pierde por completo la ventaja que brinda el uso de un soporte sólido. Además, el carácter poliiónico de las cadenas codificantes de ADN limita la utilidad de los solventes no acuosos en la síntesis. Por esta razón, muchos laboratorios optan por desarrollar reacciones compatibles con el ADN para su uso en la síntesis de DECL. Ya se han descrito bastantes de las disponibles [51] [52] [53]
La ciencia de los materiales ha aplicado las técnicas de la química combinatoria al descubrimiento de nuevos materiales. Este trabajo fue iniciado por PG Schultz et al. a mediados de los noventa [54] en el contexto de materiales luminiscentes obtenidos por codeposición de elementos sobre un sustrato de silicio. Su trabajo fue precedido por JJ Hanak en 1970 [55] pero las herramientas informáticas y robóticas no estaban disponibles para que el método se difundiera en ese momento. El trabajo ha sido continuado por varios grupos académicos [56] [57] [58] [59] así como empresas con grandes programas de investigación y desarrollo ( Symyx Technologies , GE , Dow Chemical , etc.). La técnica se ha utilizado ampliamente para catálisis, [60] recubrimientos, [61] electrónica, [62] y muchos otros campos. [63] La aplicación de herramientas informáticas apropiadas es fundamental para manejar, administrar y almacenar los grandes volúmenes de datos producidos. [64] También se han desarrollado nuevos tipos de métodos de diseño de experimentos para abordar de manera eficiente los grandes espacios experimentales que se pueden abordar utilizando métodos combinatorios. [65]
Aunque la química combinatoria ha sido una parte esencial del descubrimiento temprano de fármacos durante más de dos décadas, hasta ahora solo un producto químico sintetizado mediante química combinatoria de novo ha sido aprobado para uso clínico por la FDA ( sorafenib , un inhibidor de multiquinasas indicado para el cáncer renal avanzado). [66] Se ha sugerido que el análisis de la baja tasa de éxito del enfoque se relaciona con el espacio químico bastante limitado cubierto por los productos de la química combinatoria. [67] Al comparar las propiedades de los compuestos en las bibliotecas de química combinatoria con las de los medicamentos aprobados y los productos naturales, Feher y Schmidt [67] observaron que las bibliotecas de química combinatoria sufren particularmente de la falta de quiralidad , así como de rigidez estructural, ambas ampliamente consideradas como propiedades similares a las de los medicamentos. Aunque el descubrimiento de fármacos a partir de productos naturales probablemente no ha sido la tendencia más de moda en la industria farmacéutica en los últimos tiempos, [2] una gran proporción de nuevas entidades químicas todavía son compuestos derivados de la naturaleza, [68] [69] [70] [71] y, por lo tanto, se ha sugerido que la eficacia de la química combinatoria podría mejorarse mejorando la diversidad química de las bibliotecas de detección. [72] Como la quiralidad y la rigidez son las dos características más importantes que distinguen a los fármacos aprobados y los productos naturales de los compuestos en las bibliotecas de química combinatoria, estos son los dos problemas que se enfatizan en las llamadas bibliotecas orientadas a la diversidad, es decir, colecciones de compuestos que apuntan a la cobertura del espacio químico, en lugar de solo grandes cantidades de compuestos. [73] [74] [75] [76] [77] [78]
En la octava edición de la Clasificación Internacional de Patentes (CIP), que entró en vigor el 1 de enero de 2006, se ha creado una subclase especial para solicitudes de patentes y patentes relacionadas con invenciones en el dominio de la química combinatoria: "C40B".