La batería de níquel-cadmio ( batería Ni-Cd o batería NiCad ) es un tipo de batería recargable que utiliza hidróxido de óxido de níquel y cadmio metálico como electrodos . La abreviatura Ni-Cd se deriva de los símbolos químicos de níquel (Ni) y cadmio (Cd): la abreviatura NiCad es una marca registrada de SAFT Corporation , aunque esta marca se usa comúnmente para describir todas las baterías de Ni-Cd.
Las baterías de níquel-cadmio de celda húmeda se inventaron en 1899. Una batería de Ni-Cd tiene un voltaje terminal durante la descarga de alrededor de 1,2 voltios, que disminuye poco hasta casi el final de la descarga. La fuerza electromotriz máxima que ofrece una celda de Ni-Cd es de 1,3 V. Las baterías de Ni-Cd se fabrican en una amplia gama de tamaños y capacidades, desde tipos portátiles sellados intercambiables con celdas secas de carbono y zinc hasta grandes celdas ventiladas utilizadas para energía de reserva. y fuerza motriz. En comparación con otros tipos de pilas recargables, ofrecen un buen ciclo de vida y rendimiento a bajas temperaturas con una capacidad aceptable, pero su ventaja significativa es la capacidad de ofrecer prácticamente toda su capacidad nominal a altas velocidades de descarga (descarga en una hora o menos). Sin embargo, los materiales son más costosos que los de la batería de plomo-ácido y las celdas tienen altas tasas de autodescarga.
Las celdas selladas de Ni-Cd alguna vez se usaron ampliamente en herramientas eléctricas portátiles, equipos fotográficos, linternas , iluminación de emergencia, RC para pasatiempos y dispositivos electrónicos portátiles. La capacidad superior de las baterías de níquel-hidruro metálico y su reciente menor costo han suplantado en gran medida el uso de Ni-Cd. Además, el impacto medioambiental de la eliminación del metal tóxico cadmio ha contribuido considerablemente a la reducción de su uso. Dentro de la Unión Europea, las baterías de Ni-Cd ahora solo se pueden suministrar con fines de reemplazo o para ciertos tipos de equipos nuevos, como dispositivos médicos. [2]
Las baterías de Ni-Cd de celda húmeda ventiladas de mayor tamaño se utilizan en iluminación de emergencia, energía de reserva y sistemas de alimentación ininterrumpida y otras aplicaciones.
La primera batería de Ni-Cd fue creada por Waldemar Jungner de Suecia en 1899. En ese momento, el único competidor directo era la batería de plomo-ácido , que era menos robusta física y químicamente. Con mejoras menores en los primeros prototipos, la densidad de energía aumentó rápidamente a aproximadamente la mitad de la de las baterías primarias y significativamente mayor que la de las baterías de plomo-ácido. Jungner experimentó sustituyendo el cadmio por hierro en cantidades variables, pero descubrió que las formulaciones de hierro eran deficientes. El trabajo de Jungner era en gran medida desconocido en Estados Unidos. Thomas Edison patentó una batería de níquel o cobalto-cadmio en 1902, [3] y adaptó el diseño de la batería cuando introdujo la batería de níquel-hierro en los EE. UU. dos años después de que Jungner construyera una. En 1906, Jungner estableció una fábrica cerca de Oskarshamn, Suecia, para producir baterías de Ni-Cd de diseño inundado.
En 1932, se depositaron materiales activos dentro de un electrodo poroso niquelado y quince años más tarde se comenzó a trabajar en una batería sellada de níquel-cadmio.
La primera producción en los Estados Unidos comenzó en 1946. Hasta ese momento, las baterías eran "de bolsillo", construidas con bolsas de acero niquelado que contenían materiales activos de níquel y cadmio . A mediados del siglo XX, las baterías de placas sinterizadas de Ni-Cd se hicieron cada vez más populares. La fusión de polvo de níquel a una temperatura muy por debajo de su punto de fusión mediante altas presiones crea placas sinterizadas. Las placas así formadas son muy porosas, alrededor del 80 por ciento en volumen. Las placas positivas y negativas se producen sumergiendo las placas de níquel en materiales activos de níquel y cadmio, respectivamente. Las placas sinterizadas suelen ser mucho más delgadas que las de bolsillo, lo que da como resultado una mayor superficie por volumen y corrientes más altas. En general, cuanto mayor sea la cantidad de superficie de material reactivo en una batería, menor será su resistencia interna .
Desde la década de 2000, todas las baterías de consumo de Ni-Cd utilizan la configuración de rollo de gelatina . [ cita necesaria ]
La tasa de descarga máxima de una batería de Ni-Cd varía según el tamaño. Para una celda de tamaño AA común , la tasa de descarga máxima es de aproximadamente 1,8 amperios; para una batería de tamaño D, la velocidad de descarga puede llegar a 3,5 amperios. [ cita necesaria ]
Los constructores de modelos de aviones o barcos suelen tomar corrientes mucho mayores, de hasta cien amperios aproximadamente, de baterías de Ni-Cd especialmente construidas, que se utilizan para accionar los motores principales. Se pueden lograr fácilmente entre 5 y 6 minutos de funcionamiento del modelo con baterías bastante pequeñas, por lo que se logra una relación potencia-peso razonablemente alta, comparable a la de los motores de combustión interna , aunque de menor duración. Sin embargo, en esto han sido reemplazadas en gran medida por las baterías de polímero de litio (LiPo) y de fosfato de hierro y litio (LiFe), que pueden proporcionar densidades de energía aún mayores.
Las celdas de Ni-Cd tienen un potencial nominal de celda de 1,2 voltios (V). Esto es inferior a los 1,5 V de las pilas primarias alcalinas y de zinc-carbono y, en consecuencia, no son apropiadas como reemplazo en todas las aplicaciones. Sin embargo, los 1,5 V de una pila alcalina primaria se refieren a su voltaje inicial, más que al promedio. A diferencia de las pilas primarias alcalinas y de zinc-carbono, el voltaje terminal de una pila de Ni-Cd sólo cambia un poco a medida que se descarga. Debido a que muchos dispositivos electrónicos están diseñados para funcionar con celdas primarias que pueden descargarse hasta 0,90 a 1,0 V por celda, los 1,2 V relativamente estables de una celda de Ni-Cd son suficientes para permitir el funcionamiento. Algunos considerarían que el voltaje casi constante es un inconveniente, ya que dificulta detectar cuando la carga de la batería es baja.
Las baterías de Ni-Cd que se utilizan para reemplazar las baterías de 9 V generalmente solo tienen seis celdas, para un voltaje terminal de 7,2 voltios. Si bien la mayoría de las radios de bolsillo funcionan satisfactoriamente con este voltaje, algunos fabricantes, como Varta , fabricaron baterías de 8,4 voltios con siete celdas para aplicaciones más críticas.
Las baterías de Ni-Cd se pueden cargar a diferentes velocidades, dependiendo de cómo se fabricó la celda. La tasa de carga se mide en función del porcentaje de la capacidad de amperios-hora que la batería recibe como corriente constante durante la duración de la carga. Independientemente de la velocidad de carga, se debe suministrar más energía a la batería que su capacidad real, para tener en cuenta la pérdida de energía durante la carga, siendo las cargas más rápidas las más eficientes. Por ejemplo, una carga "durante la noche" podría consistir en suministrar una corriente igual a una décima parte del amperio-hora (C/10) durante 14 a 16 horas; es decir, una batería de 100 mAh necesita 10 mA durante 14 horas, para un total de 140 mAh para cargarse a este ritmo. A la velocidad de carga rápida, realizada al 100% de la capacidad nominal de la batería en 1 hora (1C), la batería retiene aproximadamente el 80% de la carga, por lo que una batería de 100 mAh necesita 125 mAh para cargarse (es decir, aproximadamente 1 hora y quince minutos). Algunas baterías especializadas se pueden cargar en tan solo 10 a 15 minutos a una velocidad de carga de 4C o 6C, pero esto es muy poco común. También aumenta en gran medida el riesgo de que las celdas se sobrecalienten y ventilen debido a una condición de sobrepresión interna: la tasa de aumento de temperatura de la celda se rige por su resistencia interna y el cuadrado de la tasa de carga. A una velocidad de 4°C, la cantidad de calor generada en la celda es dieciséis veces mayor que el calor a una velocidad de 1°C. La desventaja de una carga más rápida es el mayor riesgo de sobrecarga , que puede dañar la batería. y el aumento de temperaturas que la celda tiene que soportar (lo que potencialmente acorta su vida).
El rango de temperatura seguro cuando está en uso es entre −20 °C y 45 °C. Durante la carga, la temperatura de la batería normalmente se mantiene baja, aproximadamente la misma que la temperatura ambiente (la reacción de carga absorbe energía), pero a medida que la batería se acerca a la carga completa, la temperatura aumentará a 45-50 °C. Algunos cargadores de baterías detectan este aumento de temperatura para cortar la carga y evitar la sobrecarga.
Cuando no está bajo carga o carga, una batería de Ni-Cd se autodescargará aproximadamente un 10 % por mes a 20 °C, y hasta un 20 % por mes a temperaturas más altas. Nota; En el año 2022, la frase anterior era ciertamente cierta cuando se introdujo NiCad e incluso hace 50 años. Sin embargo, las mejoras continuas observadas hace unos 40 años conducen a un 5% mensual y hoy las baterías de NiCad tienen una autodescarga sustancialmente menor, del orden del 1% o 2% mensual. Es posible realizar una carga lenta a niveles de corriente lo suficientemente altos como para compensar esta tasa de descarga; para mantener una batería completamente cargada. Sin embargo, si la batería se va a almacenar sin usar durante un largo período de tiempo, se debe descargar hasta un máximo del 40% de su capacidad (algunos fabricantes recomiendan descargarla completamente e incluso cortocircuitarla una vez completamente descargada [ cita requerida ] ). y almacenado en un ambiente fresco y seco.
Las celdas selladas de Ni-Cd consisten en un recipiente a presión que se supone que contiene cualquier generación de gases de oxígeno e hidrógeno hasta que puedan recombinarse nuevamente en agua. Esta generación ocurre típicamente durante carga y descarga rápidas, y especialmente en condiciones de sobrecarga. Si la presión excede el límite de la válvula de seguridad, se pierde agua en forma de gas. Dado que el recipiente está diseñado para contener una cantidad exacta de electrolito, esta pérdida afectará rápidamente la capacidad de la celda y su capacidad para recibir y entregar corriente. Detectar todas las condiciones de sobrecarga exige una gran sofisticación por parte del circuito de carga y un cargador barato eventualmente dañará incluso las celdas de mejor calidad. [4]
Una celda de Ni-Cd completamente cargada contiene:
Las baterías de Ni-Cd suelen tener una carcasa metálica con una placa de sellado equipada con una válvula de seguridad autosellante . Las placas de los electrodos positivo y negativo, aisladas entre sí por el separador, están enrolladas en forma de espiral dentro de la carcasa. Esto se conoce como diseño de rollo de gelatina y permite que una celda de Ni-Cd entregue una corriente máxima mucho más alta que una celda alcalina de tamaño equivalente. Las pilas alcalinas tienen una construcción de bobina donde la carcasa de la pila está llena de electrolito y contiene una varilla de grafito que actúa como electrodo positivo. Como un área relativamente pequeña del electrodo está en contacto con el electrolito (a diferencia del diseño de rollo de gelatina), la resistencia interna para una celda alcalina de tamaño equivalente es mayor, lo que limita la corriente máxima que se puede entregar.
Las reacciones químicas en el electrodo de cadmio durante la descarga son:
Las reacciones en el electrodo de óxido de níquel son:
La reacción neta durante la descarga es
Durante la recarga, las reacciones van de derecha a izquierda. El electrolito alcalino (comúnmente KOH) no se consume en esta reacción y, por lo tanto, su gravedad específica , a diferencia de las baterías de plomo-ácido, no es una guía de su estado de carga.
Cuando Jungner construyó las primeras baterías de Ni-Cd, utilizó óxido de níquel en el electrodo positivo y materiales de hierro y cadmio en el negativo. No fue hasta más tarde que se utilizaron cadmio metálico puro e hidróxido de níquel. Hasta aproximadamente 1960, la reacción química no se comprendió completamente. Hubo varias especulaciones sobre los productos de la reacción. El debate finalmente se resolvió mediante espectroscopia infrarroja , que reveló hidróxido de cadmio e hidróxido de níquel.
Otra variación históricamente importante de la celda básica de Ni-Cd es la adición de hidróxido de litio al electrolito de hidróxido de potasio. Esto fue creído [ ¿por quién? ] para prolongar la vida útil haciendo que la celda sea más resistente al abuso eléctrico. De todos modos, la batería de Ni-Cd en su forma moderna es extremadamente resistente al abuso eléctrico, por lo que esta práctica se ha descontinuado.

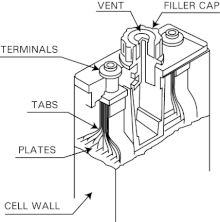
Las celdas inundadas más grandes se utilizan para baterías de arranque de aviones , energía de reserva y, marginalmente, en vehículos eléctricos .
Las baterías de Ni-Cd de celda ventilada ( celda húmeda , celda inundada ) se utilizan cuando se requieren grandes capacidades y altas tasas de descarga. A diferencia de las celdas típicas de Ni-Cd, que están selladas (consulte la siguiente sección), las celdas ventiladas tienen un respiradero o una válvula de liberación de baja presión que libera los gases de oxígeno e hidrógeno generados cuando se sobrecargan o se descargan rápidamente. Al no ser un recipiente a presión , la batería es más segura, pesa menos y tiene una estructura más sencilla y económica. Esto también significa que la batería normalmente no se daña por índices excesivos de sobrecarga, descarga o incluso carga negativa.
Se utilizan en aviación, ferrocarril y transporte público, energía de respaldo para telecomunicaciones, arranque de motores para turbinas de respaldo, etc. El uso de baterías de Ni-Cd de celdas ventiladas resulta en una reducción de tamaño, peso y requisitos de mantenimiento en comparación con otros tipos de baterías. Las baterías de Ni-Cd de celdas ventiladas tienen una larga vida útil (hasta 20 años o más, según el tipo) y funcionan a temperaturas extremas (de -40 a 70 °C).
Una caja de batería de acero contiene las celdas conectadas en serie para obtener el voltaje deseado (1,2 V por celda nominal). Las celdas suelen estar hechas de una poliamida ( nylón ) liviana y duradera, con múltiples placas de níquel-cadmio soldadas entre sí para cada electrodo en el interior. Un separador o revestimiento hecho de caucho de silicona actúa como aislante y barrera de gas entre los electrodos. Las células se inundan con un electrolito de una solución acuosa de hidróxido de potasio ( KOH ) al 30% . La gravedad específica del electrolito no indica si la batería está descargada o completamente cargada, pero cambia principalmente con la evaporación del agua. La parte superior de la celda contiene un espacio para el exceso de electrolito y un respiradero de liberación de presión. Los grandes pernos de cobre niquelado y los gruesos eslabones de interconexión garantizan una resistencia mínima equivalente en serie para la batería.
La ventilación de gases significa que la batería se descarga a un ritmo elevado o se recarga a un ritmo superior al nominal. Esto también significa que el electrolito perdido durante la ventilación debe reemplazarse periódicamente mediante un mantenimiento de rutina. Dependiendo de los ciclos de carga-descarga y del tipo de batería, esto puede significar un período de mantenimiento de desde unos pocos meses hasta un año.
El voltaje de la celda ventilada aumenta rápidamente al final de la carga, lo que permite utilizar un circuito de carga muy simple. Por lo general, una batería se carga con corriente constante a una velocidad de 1 CA hasta que todas las celdas hayan alcanzado al menos 1,55 V. Sigue otro ciclo de carga a una velocidad de 0,1 CA, nuevamente hasta que todas las celdas hayan alcanzado 1,55 V. La carga finaliza con una ecualización o carga superior. carga adicional, generalmente durante al menos 4 horas a una tarifa de 0,1 CA. El propósito de la sobrecarga es expulsar la mayor cantidad (si no todos) de los gases recolectados en los electrodos, hidrógeno en el negativo y oxígeno en el positivo, y algunos de estos gases se recombinan para formar agua que a su vez elevará la temperatura. Lleve el nivel de electrolito a su nivel más alto, después del cual será seguro ajustar los niveles de electrolito. Durante la sobrecarga o recarga, los voltajes de las celdas superarán los 1,6 V y luego comenzarán a caer lentamente. Ninguna celda debe elevarse por encima de 1,71 V (celda seca) ni caer por debajo de 1,55 V (barrera de gas rota). [ cita necesaria ]
En una instalación de aeronave con un sistema eléctrico de batería flotante, el voltaje del regulador se configura para cargar la batería a una carga potencial constante (normalmente 14 o 28 V). Si este voltaje se establece demasiado alto, se producirá una rápida pérdida de electrolitos. Un regulador de carga defectuoso puede permitir que el voltaje de carga aumente muy por encima de este valor, provocando una sobrecarga masiva con desbordamiento del electrolito. [ cita necesaria ]

La mayoría de los usos que se describen a continuación se muestran con fines históricos, ya que las baterías selladas (portátiles) de Ni-Cd han sido progresivamente desplazadas por celdas de Li-ion de mayor rendimiento, y su comercialización en el mercado de la UE ha estado, en su mayor parte, prohibida desde 2006 por la Directiva de Baterías de la UE 2006/66/EC.
Las celdas selladas de Ni-Cd se usaron individualmente o se ensamblaron en paquetes de baterías que contenían dos o más celdas. Las celdas pequeñas se utilizan para dispositivos electrónicos portátiles y juguetes (como luces solares para jardines), a menudo utilizando celdas fabricadas en los mismos tamaños que las celdas primarias . Cuando se sustituyen las celdas primarias por baterías de Ni-Cd, el menor voltaje terminal y la menor capacidad de amperios-hora pueden reducir el rendimiento en comparación con las celdas primarias. Las pilas de botón en miniatura se utilizan a veces en equipos fotográficos, lámparas de mano (linterna o antorcha), memoria de computadora en espera, juguetes y novedades.
Se utilizaron baterías especiales de Ni-Cd en teléfonos inalámbricos e inalámbricos, iluminación de emergencia y otras aplicaciones. Con una resistencia interna relativamente baja , pueden suministrar altas sobrecorrientes . Esto los convierte en una opción favorable para modelos de aviones, barcos y automóviles eléctricos controlados a distancia, así como para herramientas eléctricas inalámbricas y unidades de flash de cámara.
Los avances en las tecnologías de fabricación de baterías a lo largo de la segunda mitad del siglo XX han hecho que su producción sea cada vez más barata. Los dispositivos que funcionan con baterías en general han ganado popularidad. En el año 2000, se producían anualmente alrededor de 1.500 millones de baterías de Ni-Cd. [5] Hasta mediados de la década de 1990, las baterías de Ni-Cd tenían una abrumadora mayoría de la cuota de mercado de baterías recargables en la electrónica doméstica.
En un momento, las baterías de Ni-Cd representaron el 8% de todas las ventas de baterías secundarias (recargables) portátiles en la UE, y en el Reino Unido el 9,2% (eliminación) y en Suiza el 1,3% de todas las ventas de baterías portátiles. [6] [7] [8]
En la UE, la Directiva sobre baterías de 2006 restringió las ventas de baterías de Ni-Cd a consumidores para dispositivos portátiles.
Las celdas de Ni-Cd están disponibles en los mismos tamaños que las baterías alcalinas , desde AAA hasta D, así como en varios tamaños de celdas múltiples, incluido el equivalente a una batería de 9 voltios. Una sola celda de Ni-Cd completamente cargada, sin carga, tiene una diferencia de potencial de entre 1,25 y 1,35 voltios, que permanece relativamente constante a medida que se descarga la batería. Dado que una batería alcalina casi completamente descargada puede ver caer su voltaje hasta 0,9 voltios, las celdas de Ni-Cd y las celdas alcalinas suelen ser intercambiables para la mayoría de las aplicaciones.
Además de las celdas individuales, existen baterías que contienen hasta 300 celdas (nominalmente 360 voltios, voltaje real sin carga entre 380 y 420 voltios). Este diseño de celdas múltiples se utiliza principalmente en aplicaciones industriales automotrices y de servicio pesado. Para aplicaciones portátiles, el número de celdas normalmente es inferior a 18 celdas (24 V). Se encuentran disponibles baterías líquidas de tamaño industrial con capacidades que van desde 12,5 Ah hasta varios cientos de Ah.
Recientemente, las baterías de hidruro metálico de níquel y de iones de litio están disponibles comercialmente y son más baratas; el primer tipo ahora rivaliza en costo con las baterías de Ni-Cd. Cuando la densidad de energía es importante, las baterías de Ni-Cd se encuentran ahora en desventaja en comparación con las baterías de níquel-hidruro metálico y de iones de litio. Sin embargo, la batería de Ni-Cd sigue siendo muy útil en aplicaciones que requieren tasas de descarga muy altas porque puede soportar dicha descarga sin daños ni pérdida de capacidad.
En comparación con otras formas de batería recargable, la batería de Ni-Cd tiene varias ventajas distintas:
La principal desventaja de las baterías de Ni-Cd es su mayor costo y el uso de cadmio. Este metal pesado es un peligro para el medio ambiente y es altamente tóxico para todas las formas de vida superiores. También son más costosas que las baterías de plomo-ácido porque el níquel y el cadmio cuestan más. Una de las mayores desventajas es que la batería presenta un coeficiente de temperatura negativo muy marcado. Esto significa que a medida que aumenta la temperatura de la celda, la resistencia interna disminuye. Esto puede plantear problemas de carga considerables, particularmente con los sistemas de carga relativamente simples empleados para baterías de tipo plomo-ácido . Mientras que las baterías de plomo-ácido se pueden cargar simplemente conectándoles una dinamo , con un simple sistema de corte electromagnético para cuando la dinamo está estacionaria o se produce una sobrecorriente, la batería de Ni-Cd bajo un esquema de carga similar exhibiría características térmicas. fuera de control, donde la corriente de carga continuaría aumentando hasta que el corte por sobrecorriente funcionara o la batería se destruyera. Este es el principal factor que impide su uso como baterías de arranque de motores. Hoy en día, con los sistemas de carga basados en alternadores con reguladores de estado sólido, construir un sistema de carga adecuado sería relativamente sencillo, pero los fabricantes de automóviles se resisten a abandonar la tecnología ya probada. [9]
Las baterías de Ni-Cd pueden sufrir un " efecto memoria " si se descargan y recargan hasta el mismo estado de carga cientos de veces. El síntoma aparente es que la batería "recuerda" el punto de su ciclo de descarga en el que se inició la recarga y durante el uso posterior sufre una caída brusca de tensión en ese punto, como si la batería se hubiera descargado. En realidad, la capacidad de la batería no se reduce sustancialmente. Algunos dispositivos electrónicos diseñados para funcionar con baterías de Ni-Cd pueden resistir este voltaje reducido el tiempo suficiente para que el voltaje vuelva a la normalidad. Sin embargo, si el dispositivo no puede funcionar durante este período de disminución de voltaje, no podrá obtener suficiente energía de la batería y, a todos los efectos prácticos, la batería parece "agotada" antes de lo normal.
Hay evidencia de que la historia del efecto memoria se originó en satélites en órbita, donde se cargaban y descargaban de manera similar en cada órbita alrededor de la Tierra durante un período de varios años. [10] Después de este tiempo, se descubrió que las capacidades de las baterías habían disminuido significativamente, pero aún estaban aptas para su uso. Es poco probable que esta carga repetitiva precisa (por ejemplo, 1.000 cargas/descargas con menos del 2% de variabilidad) pueda ser reproducida alguna vez por personas que utilizan aparatos eléctricos. El artículo original que describe el efecto memoria fue escrito por científicos de GE en su Departamento de Negocios de Baterías en Gainesville, Florida, y luego se retractaron, pero el daño ya estaba hecho. [11]
La batería sobrevive miles de ciclos de cargas/descargas. También es posible reducir el efecto memoria descargando completamente la batería aproximadamente una vez al mes. [ cita necesaria ] De esta manera aparentemente la batería no "recuerda" el punto de su ciclo de carga.
Un efecto con síntomas similares al efecto memoria es la llamada depresión de voltaje o efecto de batería perezosa . Esto se debe a la sobrecarga repetida; el síntoma es que la batería parece estar completamente cargada pero se descarga rápidamente después de un breve período de funcionamiento. En casos raros, gran parte de la capacidad perdida se puede recuperar mediante unos pocos ciclos de descarga profunda, una función que suelen proporcionar los cargadores de baterías automáticos. Sin embargo, este proceso puede reducir la vida útil de la batería. [ cita necesaria ] Si se trata bien, una batería de Ni-Cd puede durar 1000 ciclos o más antes de que su capacidad caiga por debajo de la mitad de su capacidad original. Muchos cargadores domésticos afirman ser "cargadores inteligentes" que se apagarán y no dañarán la batería, pero este parece ser un problema común. [ cita necesaria ]
Las baterías de Ni-Cd contienen entre un 6% (para baterías industriales) y un 18% (para baterías comerciales) de cadmio , que es un metal pesado tóxico y, por lo tanto, requiere especial cuidado al desechar la batería.
En los Estados Unidos , el costo esperado de reciclaje de la batería (que se utilizará para su eliminación adecuada al final de su vida útil) se incluye en el precio de compra de la batería.
Según la llamada "directiva sobre baterías" ( 2006/66/CE ), la venta de baterías de consumo Ni-Cd ahora ha sido prohibida dentro de la Unión Europea, excepto para uso médico; sistemas de alarma; iluminación de emergencia; y herramientas eléctricas portátiles. Esta última categoría ha sido prohibida a partir de 2016. [12] Según la misma directiva de la UE, las baterías industriales de Ni-Cd usadas deben ser recogidas por sus productores para poder reciclarlas en instalaciones dedicadas.