
En la química huésped-anfitrión , los cucurbiturilos son moléculas macrocíclicas formadas por monómeros de glicolurilo ( =C 4 H 2 N 4 O 2 = ) unidos por puentes de metileno ( −CH 2 − ). Los átomos de oxígeno se encuentran a lo largo de los bordes de la banda y están inclinados hacia adentro, formando una cavidad parcialmente cerrada ( cavitando ). El nombre se deriva del parecido de esta molécula con una calabaza de la familia de las Cucurbitaceae .
Los cucurbiturilos se escriben comúnmente como cucurbit[ n ]uril , donde n es el número de unidades de glicolurilo. Dos abreviaturas comunes son CB[ n ] o simplemente CB n .
Estos compuestos son particularmente interesantes para los químicos porque son huéspedes adecuados para una variedad de especies neutras y catiónicas. Se cree que el modo de unión ocurre a través de interacciones hidrofóbicas y, en el caso de huéspedes catiónicos, también a través de interacciones catión-dipolo. Las dimensiones de los cucurbiturilos están generalmente en la escala de tamaño de ~10 Å . Por ejemplo, la cavidad del cucurbitáceo[6]uril tiene una altura de ~9,1 Å, un diámetro externo de ~5,8 Å y un diámetro interno de ~3,9 Å. [1]
Los cucurbiturilos fueron sintetizados por primera vez en 1905 por Robert Behrend , condensando glicolurilo con formaldehído , [2] pero su estructura no se dilucidó hasta 1981. [3] El campo se expandió cuando Kim Kimoon descubrió y aisló CB5, CB7 y CB8 en el año 2000. [4] Hasta la fecha, se han aislado cucurbiturilos compuestos de 5, 6, 7, 8, 10 y 14 unidades repetidas, [5] [6] que tienen volúmenes de cavidad interna de 82, 164, 279, 479 y 870 Å 3 respectivamente. Aún no se ha aislado un cucurbiturilo compuesto de 9 unidades repetidas (a fecha de 2009). Otras cápsulas moleculares comunes que comparten una forma molecular similar con los cucurbiturilos incluyen ciclodextrinas , calixarenos y pillararenos .
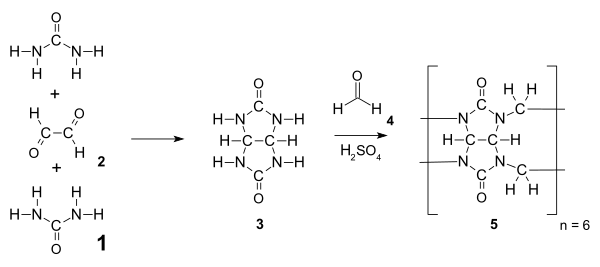
Los cucurbiturilos son amidales (menos precisamente aminales ) y se sintetizan a partir de urea 1 y un dialdehído (p. ej., glioxal 2 ) mediante una adición nucleofílica para dar el intermedio glicolurilo 3. Este intermedio se condensa con formaldehído para dar cucurbit[6]uril hexamérico por encima de 110 °C. Por lo general, los monómeros multifuncionales como 3 sufrirían una polimerización por crecimiento escalonado que daría una distribución de productos, pero debido a la tensión favorable y a la abundancia de enlaces de hidrógeno , el hexámero es el único producto de reacción aislado después de la precipitación. [5]
La reducción de la temperatura de la reacción a un rango de entre 75 y 90 °C puede utilizarse para acceder a otros tamaños de cucurbiturilos, incluidos CB[5], CB[7], CB[8] y CB[10]. CB[6] sigue siendo el producto principal; los otros tamaños de anillo se forman en rendimientos más pequeños. El aislamiento de tamaños distintos de CB[6] requiere cristalización fraccionada y disolución. CB[5], CB[6], CB[7] y CB[8] están disponibles comercialmente en la actualidad. Los tamaños más grandes son un área de investigación particularmente activa ya que pueden unir moléculas huésped más grandes e interesantes, expandiendo así sus aplicaciones potenciales.

El cucurbituril[10] es particularmente difícil de aislar. Fue descubierto por primera vez por Day y colaboradores en 2002 como un complejo de inclusión que contenía CB[5] mediante cristalización fraccionada de la mezcla de reacción del cucurbituril. [7] El CB[10]·CB[5] se identificó de forma inequívoca mediante un análisis estructural de rayos X de un solo cristal que reveló que el complejo se parecía a un giroscopio molecular . En este caso, la rotación libre del CB[5] dentro de la cavidad del CB[10] imita la rotación independiente de un volante dentro del marco de un giroscopio.
El aislamiento de CB[10] puro no se pudo lograr mediante métodos de separación directa ya que el compuesto tiene una afinidad tan alta por CB[5]. La fuerte afinidad de unión por el CB[5] se puede entender ya que tiene un tamaño y una forma complementarios a la cavidad del CB[10]. El CB[10] puro fue aislado por Isaacs y colaboradores en 2005 introduciendo un huésped de diamina de melamina de unión más fuerte que es capaz de desplazar al CB[5]. [8] El huésped de diamina de melamina se separó luego del CB[10] por reacción con anhídrido acético que convirtió los grupos amina cargados positivamente en amidas cargadas neutramente. Los cucurbiturilos se unen fuertemente a los huéspedes catiónicos, pero al eliminar la carga positiva del huésped de diamina de melamina se reduce la constante de asociación hasta el punto en que se puede eliminar lavando con metanol , DMSO y agua. El CB[10] tiene una cavidad inusualmente grande (870 Å 3 ) que está libre y es capaz de unir huéspedes extraordinariamente grandes, incluido un calix[4]areno catiónico .
Los químicos han utilizado cucurbiturilos para diversas aplicaciones, incluida la administración de fármacos, la síntesis asimétrica, la conmutación molecular y el ajuste de colorantes.

Los cucurbiturilos son moléculas hospedantes eficientes en el reconocimiento molecular y tienen una afinidad particularmente alta por compuestos catiónicos o con carga positiva. Las constantes de asociación altas con moléculas con carga positiva se atribuyen a los grupos carbonilo que recubren cada extremo de la cavidad y pueden interactuar con cationes de manera similar a los éteres corona. La afinidad de los cucurbiturilos puede ser muy alta. Por ejemplo, la constante de equilibrio de afinidad del cucurbiturilo[7] con el clorhidrato de 1-aminoadamantano con carga positiva se determinó experimentalmente en 4,23*10 12 . [10]
Las interacciones entre el huésped y el huésped también influyen significativamente en el comportamiento de solubilidad de los cucurbiturilos. El cucurbiturilo[6] se disuelve mal en casi cualquier solvente, pero la solubilidad mejora considerablemente en una solución de hidróxido de potasio o en una solución ácida . El cavitando forma un compuesto de inclusión cargado positivamente con un ion de potasio o un ion de hidronio respectivamente, que tienen una solubilidad mucho mayor que la molécula neutra no complejada. [11]
CB[10] es lo suficientemente grande como para albergar otros hospedadores moleculares, como una molécula de calixareno . Con un huésped de calixareno, diferentes conformaciones químicas (cono, 1,2-alterna, 1,3-alterna) se encuentran en rápido equilibrio. El control alostérico se proporciona cuando una molécula de adamantano fuerza una conformación de cono con un complejo de inclusión de calixareno-adamantano dentro de una molécula CB[10].
Dada su alta afinidad para formar complejos de inclusión, los cucurbiturilos se han empleado como el componente macrocíclico de un rotaxano . Después de la formación del ensamblaje supramolecular o complejo en cadena con una molécula huésped, como la hexametilendiamina, los dos extremos del huésped pueden reaccionar con grupos voluminosos que luego actuarán como tapones que evitarán que las dos moléculas separadas se disocien. [12]
En otro sistema de rotaxano con una rueda CB[7], el eje es una subunidad de viológeno o bipiridinio 4,4' con dos sustituyentes N alifáticos terminados en ácido carboxílico en ambos extremos. [13] En agua a una concentración superior a 0,5 mM, la formación de complejos es cuantitativa sin necesidad de topes. A pH = 2, los grupos terminales carboxílicos están protonados y la rueda se desplaza de un lado a otro entre ellos, como lo demuestra la presencia de solo dos protones aromáticos de viológeno en el espectro de RMN de protones . A pH = 9, la rueda está bloqueada alrededor del centro de viológeno. Más recientemente, se sintetizó rotaxano [14] con una rueda CB[8]. Este rotaxano puede unirse a moléculas huésped neutras.
Las propiedades de hospedador-huésped del cucurbituril se han explorado para vehículos de administración de fármacos. [15] El potencial de esta aplicación se ha explorado con el cucurbituril[7] que forma un compuesto de inclusión con el importante fármaco contra el cáncer oxaliplatino . Se empleó CB[7] a pesar del hecho de que es más difícil de aislar ya que tiene una solubilidad mucho mayor en agua y su mayor tamaño de cavidad puede acomodar la molécula del fármaco. Se descubrió que el complejo resultante tenía una mayor estabilidad y una mayor selectividad que puede conducir a menos efectos secundarios. [16]
Los cucurbiturilos también se han explorado como catalizadores supramoleculares . Los cucurbiturilos más grandes, como el cucurbit[8]uril, pueden unirse a múltiples moléculas huésped. CB[8] forma un complejo 2:1 (huésped:huésped) con el dihidrocloruro de (E)-diaminoestilbeno que se acomoda al mayor diámetro interno de CB[8] de 8,8 angstroms y altura de 9,1 angstroms . [17] La proximidad cercana y la orientación óptima de las moléculas huésped dentro de la cavidad mejoran la velocidad de la ciclización fotoquímica para dar un dímero de ciclobutano con una estereoselectividad de 19:1 para la configuración syn cuando se une a CB[8]. En ausencia de CB[8], la reacción de ciclización no ocurre, sino que solo se observa la isomerización del isómero trans al isómero cis . [18] [19]
Los investigadores han explorado en los últimos años las capacidades de ajuste de tinte que poseen los cucurbiturilos. [20] [21] [22] [23] En general, se ha descubierto que el entorno confinado y de baja polaridad proporcionado por los cucurbiturilos conduce a un brillo mejorado, una mayor fotoestabilidad, mayores tiempos de vida de fluorescencia y un solvatocromismo consistente con el traslado a un entorno de menor polaridad.
Los cucurbiturilos invertidos o i CB[x] son análogos de CB con una unidad repetitiva de glicolurilo invertida. [24] En esta unidad, los protones de metino apuntan hacia la cavidad y esto hace que la cavidad sea menos espaciosa. Los cucurbiturilos invertidos se forman como un producto secundario en las reacciones de formación de CB, con rendimientos entre el 2 y el 0,4%. El aislamiento de este tipo de compuesto CB es posible porque es más difícil formar compuestos de inclusión que normalmente se forman con CB regulares. Se cree que los cucurbiturilos invertidos son los productos de reacción controlados cinéticamente porque el calentamiento de i CB[6] en medio ácido da como resultado una mezcla de CB[5], CB[6] y CB[7] en una proporción de 24:13:1.
Un cucurbiturilo cortado por la mitad a lo largo del ecuador se llama hemicucurbiturilo .
El nombre sistemático de las cucurbitáceas[6]uril es dodecahidro-1H,4H,14H,17H-2,16:3,15-dimetano-5H,6H,7H,8H,9H,10H,11H,12H,13H,18H,19H. 20H,21H,22H,23H,24H,25H,26H-2,3,4a,5a,6a,7a,8a,9a,10a,11a,12a,13a,15,16,17a,18a,19a,20a, 21a,22a,23a,24a,25a,26a-tetracosa azabispentaleno[1'',6''':5'',6'',7'']ciclooctilo[1'',2'',3'':3',4']pentaleno(1',6 ':5,6,7)-cicloocta(1,2,3-gh:1',2',3'-g'h')cicloocta(1,2,3-cd:5,6,7-c 'd')dipentaleno-1,4,6,8,10,12,14,17,19,21,23,25-dodecona. [25] [26]