Un enlace cuádruple es un tipo de enlace químico entre dos átomos que involucra ocho electrones . Este enlace es una extensión de los tipos más familiares de enlaces covalentes : enlaces dobles y enlaces triples . [1] Los enlaces cuádruples estables son más comunes entre los metales de transición en el medio del bloque d , como renio , tungsteno , tecnecio , molibdeno y cromo . Normalmente, los ligandos que soportan enlaces cuádruples son donantes π , no aceptores π . Los enlaces cuádruples son raros en comparación con los enlaces dobles y los enlaces triples , pero se han preparado cientos de compuestos con dichos enlaces. [2]

El acetato de cromo (II) , Cr 2 ( μ -O 2 CCH 3 ) 4 (H 2 O) 2 , fue el primer compuesto químico que contenía un enlace cuádruple que se sintetizó. Fue descrito en 1844 por E. Peligot , aunque su vínculo distintivo no fue reconocido durante más de un siglo. [3]
El primer estudio cristalográfico de un compuesto con un enlace cuádruple fue realizado por químicos soviéticos para las sales de Re.
2CL2-8
. [4] Se observó la muy corta distancia Re-Re. Esta corta distancia (y el diamagnetismo de la sal) indicó un enlace Re-Re. Sin embargo, estos investigadores formularon erróneamente el anión como un derivado de Re (II), es decir, Re
2CL4-8
.
Poco después, F. Albert Cotton y CB Harris informaron sobre la estructura cristalina del octaclorodirhenato de potasio o K 2 [Re 2 Cl 8 ]·2H 2 O. [5] Este análisis estructural indicó que la caracterización anterior estaba equivocada. Cotton y Harris formularon una justificación orbital molecular para el enlace que indicaba explícitamente un enlace cuádruple. [3] La longitud del enlace renio-renio en este compuesto es de solo 224 pm . En la teoría de los orbitales moleculares , el enlace se describe como σ 2 π 4 δ 2 con un enlace sigma , dos enlaces pi y un enlace delta .
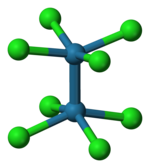

El ion [Re 2 Cl 8 ] 2− adopta una conformación eclipsada como se muestra a la izquierda. El orbital de enlace delta se forma luego mediante la superposición de los orbitales d en cada átomo de renio, que son perpendiculares al eje Re-Re y se encuentran entre los enlaces Re-Cl. Los orbitales d dirigidos a lo largo de los enlaces Re-Cl se estabilizan mediante la interacción con los orbitales del ligando de cloro y no contribuyen al enlace Re-Re. [6] En contraste, el ion [Os 2 Cl 8 ] 2− con dos electrones más (σ 2 π 4 δ 2 δ* 2 ) tiene un triple enlace Os-Os y una geometría escalonada . [6]
Se han descrito muchos otros compuestos con enlaces cuádruples entre átomos de metales de transición, a menudo por Cotton y sus colaboradores. Isoelectrónica con el compuesto de dirhenio es la sal K 4 [Mo 2 Cl 8 ] ( octaclorodimolibdato de potasio ). [7] Un ejemplo de un compuesto de ditungsteno con un enlace cuádruple es el tetra(hpp) de ditungsteno .
Se desconocen los enlaces cuádruples entre átomos de elementos del grupo principal . Para la molécula de dicarbono (C 2 ), como ejemplo, la teoría de los orbitales moleculares muestra que hay dos conjuntos de electrones apareados en el sistema sigma (uno enlazante y otro antienlazante) y dos conjuntos de electrones apareados en un conjunto degenerado de enlaces π. orbitales. Esto da como resultado un orden de enlace de 2, lo que significa que existe un doble enlace entre los dos átomos de carbono . El diagrama de orbitales moleculares del carbono diatómico mostraría que hay dos enlaces pi y ningún enlace sigma. Un artículo reciente de S. Shaik et al. ha sugerido que existe un enlace cuádruple en el dicarbono, [8] pero esto está en disputa. [9]