Una combinación lineal de orbitales atómicos o LCAO es una superposición cuántica de orbitales atómicos y una técnica para calcular orbitales moleculares en química cuántica . [1] En mecánica cuántica, las configuraciones electrónicas de los átomos se describen como funciones de onda . En un sentido matemático, estas funciones de onda son el conjunto básico de funciones, las funciones básicas, que describen los electrones de un átomo determinado. En las reacciones químicas , las funciones de onda orbitales se modifican, es decir, se cambia la forma de la nube de electrones , según el tipo de átomos que participan en el enlace químico .
Fue introducido en 1929 por Sir John Lennard-Jones con la descripción de los enlaces en las moléculas diatómicas de la primera fila principal de la tabla periódica, pero Linus Pauling lo había utilizado anteriormente para el H 2 + . [2] [3]

Una suposición inicial es que el número de orbitales moleculares es igual al número de orbitales atómicos incluidos en la expansión lineal. En cierto sentido, n orbitales atómicos se combinan para formar n orbitales moleculares, que pueden numerarse i = 1 an y que pueden no ser todos iguales. La expresión (expansión lineal) para el iésimo orbital molecular sería:
o
donde es un orbital molecular representado como la suma de n orbitales atómicos , cada uno multiplicado por un coeficiente correspondiente , y r (numerado del 1 al n ) representa qué orbital atómico se combina en el término. Los coeficientes son los pesos de las contribuciones de los n orbitales atómicos al orbital molecular. Se utiliza el método Hartree-Fock para obtener los coeficientes de expansión. Los orbitales se expresan así como combinaciones lineales de funciones básicas , y las funciones básicas son funciones de un solo electrón que pueden estar centradas o no en los núcleos de los átomos componentes de la molécula . En cualquier caso, las funciones básicas suelen denominarse también orbitales atómicos (aunque sólo en el primer caso este nombre parece adecuado). Los orbitales atómicos utilizados suelen ser los de átomos similares al hidrógeno, ya que se conocen analíticamente, es decir, orbitales de tipo Slater, pero son posibles otras opciones, como las funciones gaussianas de conjuntos de bases estándar o los orbitales pseudoatómicos de pseudopotenciales de onda plana.
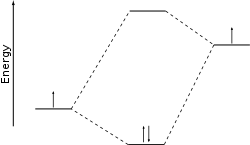
Minimizando la energía total del sistema, se determina un conjunto apropiado de coeficientes de las combinaciones lineales. Este enfoque cuantitativo se conoce ahora como método Hartree-Fock. Sin embargo, desde el desarrollo de la química computacional , el método LCAO a menudo no se refiere a una optimización real de la función de onda sino a una discusión cualitativa que es muy útil para predecir y racionalizar los resultados obtenidos mediante métodos más modernos. En este caso, la forma de los orbitales moleculares y sus respectivas energías se deducen aproximadamente comparando las energías de los orbitales atómicos de los átomos individuales (o fragmentos moleculares) y aplicando algunas recetas conocidas como repulsión de niveles y similares. Los gráficos que se trazan para aclarar esta discusión se denominan diagramas de correlación. Las energías orbitales atómicas requeridas pueden provenir de cálculos o directamente de experimentos según el teorema de Koopmans .
This is done by using the symmetry of the molecules and orbitals involved in bonding, and thus is sometimes called symmetry adapted linear combination (SALC). The first step in this process is assigning a point group to the molecule. Each operation in the point group is performed upon the molecule. The number of bonds that are unmoved is the character of that operation. This reducible representation is decomposed into the sum of irreducible representations. These irreducible representations correspond to the symmetry of the orbitals involved.
Molecular orbital diagrams provide simple qualitative LCAO treatment. The Hückel method, the extended Hückel method and the Pariser–Parr–Pople method, provide some quantitative theories.