La conjugación bacteriana es la transferencia de material genético entre células bacterianas mediante contacto directo de célula a célula o mediante una conexión tipo puente entre dos células. [1] Esto se realiza a través de un pilus . [2] Es un modo de reproducción parasexual en bacterias.
Es un mecanismo de transferencia horizontal de genes , al igual que la transformación y la transducción , aunque estos otros dos mecanismos no implican contacto entre células. [4]
La conjugación bacteriana clásica de E. coli a menudo se considera el equivalente bacteriano de la reproducción o el apareamiento sexual , ya que implica el intercambio de material genético. Sin embargo, no se trata de reproducción sexual, ya que no se produce ningún intercambio de gametos y, de hecho, no se genera ningún organismo nuevo : en cambio, se transforma un organismo existente. Durante la conjugación clásica de E. coli , la célula donante proporciona un elemento genético conjugativo o movilizable que suele ser un plásmido o un transposón . [5] La mayoría de los plásmidos conjugativos tienen sistemas que garantizan que la célula receptora no contenga ya un elemento similar.
La información genética transferida suele ser beneficiosa para el receptor. Los beneficios pueden incluir resistencia a los antibióticos , tolerancia a los xenobióticos o la capacidad de utilizar nuevos metabolitos . [6] Otros elementos pueden ser perjudiciales y pueden considerarse parásitos bacterianos .
La conjugación en Escherichia coli por cigogénesis espontánea [7] y en Mycobacterium smegmatis por transferencia conyugal distributiva [8] [9] difieren de la conjugación clásica de E. coli , mejor estudiada , en que estos casos implican una mezcla sustancial de los genomas parentales .
El proceso fue descubierto por Joshua Lederberg y Edward Tatum [10] en 1946.
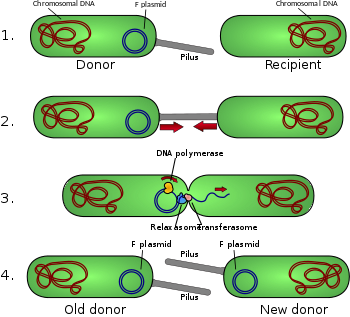
Diagrama de conjugación
El factor F es un episoma (un plásmido que puede integrarse en el cromosoma bacteriano mediante recombinación homóloga ) con una longitud de aproximadamente 100 kb . Lleva su propio origen de replicación , el oriV , y un origen de transferencia, u oriT . [5] Sólo puede haber una copia del plásmido F en una bacteria determinada, ya sea libre o integrada, y las bacterias que poseen una copia se denominan F-positivas o F-plus (denotadas como F + ). Las células que carecen de plásmidos F se denominan F negativas o F menos (F − ) y, como tales, pueden funcionar como células receptoras. [ cita necesaria ]
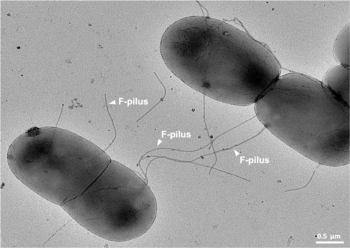
Entre otra información genética, el plásmido F porta un locus tra y trb , que juntos tienen una longitud de aproximadamente 33 kb y constan de aproximadamente 40 genes . El locus tra incluye el gen pilin y los genes reguladores, que juntos forman pili en la superficie celular. El locus también incluye los genes de las proteínas que se adhieren a la superficie de las bacterias F- e inician la conjugación. Aunque existe cierto debate sobre el mecanismo exacto de conjugación, parece que los pili son las estructuras a través de las cuales se produce el intercambio de ADN. Los F-pili son extremadamente resistentes al estrés mecánico y termoquímico, lo que garantiza una conjugación exitosa en una variedad de entornos. [11] Varias proteínas codificadas en el locus tra o trb parecen abrir un canal entre las bacterias y se cree que la enzima traD, ubicada en la base del pilus, inicia la fusión de membranas.
Cuando la conjugación se inicia mediante una señal, la enzima relaxasa crea una mella en una de las hebras del plásmido conjugativo en el oriT . La relaxasa puede funcionar sola o en un complejo de más de una docena de proteínas conocidas colectivamente como relaxosoma . En el sistema del plásmido F, la enzima relaxasa se llama TraI y el relaxosoma está formado por TraI, TraY, TraM y el factor huésped integrado IHF. Luego , la hebra mellada, o hebra T , se desenrolla de la hebra intacta y se transfiere a la célula receptora en dirección del extremo 5' al extremo 3'. La cadena restante se replica independientemente de la acción conjugativa (replicación vegetativa que comienza en el oriV ) o en conjunto con la conjugación (replicación conjugativa similar a la replicación en círculo rodante del fago lambda ). La replicación conjugativa puede requerir una segunda mella antes de que pueda ocurrir una transferencia exitosa. Un informe reciente afirma haber inhibido la conjugación con sustancias químicas que imitan un paso intermedio de este segundo evento de mellado. [12]
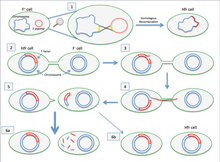
Si el plásmido F que se transfiere se ha integrado previamente en el genoma del donante (produciendo una cepa Hfr ["Alta Frecuencia de Recombinación"]), parte del ADN cromosómico del donante también puede transferirse con el ADN del plásmido. [4] La cantidad de ADN cromosómico que se transfiere depende de cuánto tiempo permanecen en contacto las dos bacterias conjugadoras. En cepas de laboratorio comunes de E. coli, la transferencia de todo el cromosoma bacteriano tarda unos 100 minutos. El ADN transferido puede luego integrarse en el genoma receptor mediante recombinación homóloga .
Un cultivo celular que contiene en su población células con plásmidos F no integrados suele contener también algunas células que han integrado accidentalmente sus plásmidos. Son estas células las responsables de las transferencias de genes cromosómicos de baja frecuencia que ocurren en tales cultivos. Algunas cepas de bacterias con un plásmido F integrado se pueden aislar y cultivar en cultivo puro. Debido a que estas cepas transfieren genes cromosómicos de manera muy eficiente, se denominan Hfr ( alta frecuencia de recombinación ). El genoma de E. coli se cartografió originalmente mediante experimentos de apareamiento interrumpidos en los que varias células Hfr en proceso de conjugación fueron cortadas de los receptores después de menos de 100 minutos (inicialmente usando una licuadora Waring). Luego se investigaron los genes transferidos.
Dado que la integración del plásmido F en el cromosoma de E. coli es una ocurrencia espontánea poco común, y dado que los numerosos genes que promueven la transferencia de ADN están en el genoma del plásmido y no en el genoma bacteriano, se ha argumentado que la transferencia conjugativa de genes bacterianos, como ocurre en el sistema Hfr de E. coli , no es una adaptación evolutiva del huésped bacteriano ni es probablemente ancestral del sexo eucariota. [14]
Cigogénesis espontánea en E. coli
Además de la conjugación bacteriana clásica descrita anteriormente para E. coli , en ciertas cepas de E. coli se observa una forma de conjugación denominada cigogénesis espontánea (apareamiento Z para abreviar) . [7] En el apareamiento Z hay una mezcla genética completa y se forman diploides inestables que desprenden células fenotípicamente haploides, de las cuales algunas muestran un fenotipo parental y otras son verdaderas recombinantes .
La conjugación en Mycobacteria smegmatis , al igual que la conjugación en E. coli , requiere un contacto estable y prolongado entre una cepa donante y una cepa receptora, es resistente a la ADNasa y el ADN transferido se incorpora al cromosoma receptor mediante recombinación homóloga. Sin embargo, a diferencia de la conjugación Hfr de E. coli , la conjugación micobacteriana se basa en cromosomas y no en plásmidos. [8] [9] Además, a diferencia de la conjugación Hfr de E. coli , en M. smegmatis todas las regiones del cromosoma se transfieren con eficiencias comparables. Las longitudes de los segmentos donantes varían ampliamente, pero tienen una longitud promedio de 44,2 kb. Dado que se transfieren una media de 13 tractos, el promedio total de ADN transferido por genoma es de 575 kb. [9] Este proceso se denomina “Transmisión conyugal distributiva”. [8] [9] Gray y cols. [8] encontraron una mezcla sustancial de los genomas parentales como resultado de la conjugación y consideraron esta mezcla como una reminiscencia de la observada en los productos meióticos de la reproducción sexual.
Las arqueas hipertermófilas codifican pili estructuralmente similares a los pili conjugativos bacterianos. [15] Sin embargo, a diferencia de las bacterias, donde los aparatos de conjugación normalmente median la transferencia de elementos genéticos móviles, como plásmidos o transposones, la maquinaria conjugativa de las arqueas hipertermófilas, llamadas Ced (sistema crenarchaeal para el intercambio de ADN) [16] y Ted ( Sistema termoproteales para el intercambio de ADN), [15] parece ser el responsable de la transferencia de ADN celular entre miembros de una misma especie. Se ha sugerido que en estas arqueas la maquinaria de conjugación ha sido completamente domesticada para promover la reparación del ADN mediante recombinación homóloga en lugar de diseminación de elementos genéticos móviles. [15] Además del pilus conjugativo similar a VirB2, los sistemas Ced y Ted incluyen componentes para el poro de apareamiento transmembrana similar a VirB6 y la ATPasa similar a VirB4. [15]

Las bacterias relacionadas con los Rhizobia fijadores de nitrógeno son un caso interesante de conjugación entre reinos . [17] Por ejemplo, el plásmido inductor de tumores (Ti) de Agrobacterium y el plásmido inductor de tumores de raíz (Ri) de A. rhizogenes contienen genes que son capaces de transferirse a células vegetales. La expresión de estos genes transforma efectivamente las células vegetales en fábricas productoras de opinión . Las bacterias utilizan las opiniones como fuente de nitrógeno y energía. Las células infectadas forman tumores de agalla de la corona o de la raíz . Los plásmidos Ti y Ri son, por tanto, endosimbiontes de las bacterias, que a su vez son endosimbiontes (o parásitos) de la planta infectada. [ cita necesaria ]
Los plásmidos Ti y Ri también se pueden transferir entre bacterias utilizando un sistema (el operón tra o transferencia ) que es diferente e independiente del sistema utilizado para la transferencia entre reinos (el operón vir o virulencia ). Estas transferencias crean cepas virulentas a partir de cepas previamente avirulentas. [ cita necesaria ]
La conjugación es un medio conveniente para transferir material genético a una variedad de objetivos. En los laboratorios, se han informado transferencias exitosas de bacterias a levaduras, [18] plantas, células de mamíferos, [19] [20] diatomeas [21] y mitocondrias de mamíferos aisladas . [22] La conjugación tiene ventajas sobre otras formas de transferencia genética, incluida una alteración mínima de la envoltura celular del objetivo y la capacidad de transferir cantidades relativamente grandes de material genético (consulte la discusión anterior sobre la transferencia de cromosomas de E. coli ). En ingeniería vegetal, la conjugación similar a Agrobacterium complementa otros vehículos estándar como el virus del mosaico del tabaco (TMV). Si bien el TMV es capaz de infectar muchas familias de plantas, éstas son principalmente dicotiledóneas herbáceas . La conjugación similar a Agrobacterium también se usa principalmente para dicotiledóneas, pero los receptores monocotiledóneas no son infrecuentes. [ cita necesaria ]
{{cite book}}: Mantenimiento CS1: bot: estado de la URL original desconocido ( enlace )