En química organometálica , los complejos de nitrito con metales de transición describen familias de complejos de coordinación que contienen uno o más ligandos de nitrito ( -NO 2 ) . [2] Aunque los derivados sintéticos son sólo de interés académico, los complejos de nitrito metálico se producen en varias enzimas que participan en el ciclo del nitrógeno . [3]

Tres isómeros de enlace son comunes para los ligandos de nitrito: con enlaces O, con enlaces N y con enlaces O,O bidentados. Los dos primeros isómeros se han caracterizado para el sistema pentaminocobalto(III), es decir, [(NH 3 ) 5 Co−NO 2 ] 2+ y [(NH 3 ) 5 Co−ONO] 2+ , denominados N-nitrito y O-nitrito, respectivamente. Estas dos formas a veces se denominan nitro y nitrito. Estos isómeros pueden interconvertirse en algunos complejos. [4]
Un ejemplo de nitrito quelante es [Cu(bipy) 2 (O 2 N)]NO 3 – "bipy" es el ligando bidentado 2,2′-bipiridilo . Este modo de enlace a veces se describe como κ 2O,O - NO 2 .
Centrándonos en el recuento de electrones en complejos monometálicos, los unidos por O y los unidos por N se consideran pseudohaluros de 1 electrón ("ligando X"). El enlace O,O bidentado es un "ligando LX", similar al carboxilato bidentado.
Con respecto a la teoría HSAB , el modo de enlace N es más común para centros metálicos más blandos. Los modos O y O,O-bidentados son ligandos duros y se encuentran en centros metálicos ácidos de Lewis.
El isómero unido a O cinéticamente favorecido [(NH 3 ) 5 Co-ONO] 2+ se convierte en [(NH 3 ) 5 Co-NO 2 ] 2+ . En su reacción con complejos de porfirina férrica , el nitrito da el isómero unido por O, Fe(porf)ONO . La adición de ligandos donantes a este complejo induce la conversión al isómero octaédrico de bajo espín, que ahora es un ácido de Lewis blando. El nitrito se isomeriza al isómero unido a N, Fe(porf)NO2 ( L) . [5]
La isomerización de [(NH 3 ) 5 Co-ONO] 2+ a [(NH 3 ) 5 Co-NO 2 ] 2+ se produce de manera intramolecular. [6]

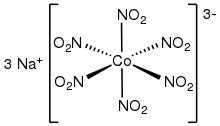
Se han caracterizado mediante cristalografía de rayos X varios complejos homolépticos (complejos con un solo tipo de ligando) . El inventario incluye complejos octaédricos [M(NO 2 ) 6 ] 3− , donde M = Co ( cobaltinitrito de sodio ) [7] [8] y Rh. Los complejos homolépticos cuadrados-planos también son conocidos por Pt(II) y Pd(II). Las sales de potasio de [M(NO 2 ) 4 ] 2− (M = Zn, Cd) presentan complejos homolépticos con cuatro ligandos de nitrito O,O-bidentados. [9]
Tradicionalmente, los complejos de nitrito metálico se preparan mediante metátesis de sales o reacciones de sustitución de ligandos utilizando sales de nitrito de metales alcalinos, como el nitrito de sodio . A pH neutro, el nitrito existe predominantemente como anión, no como ácido nitroso. [10]
Los complejos de nitrosilo metálico se someten a hidrólisis básica, dando complejos de nitrito. Este patrón se manifiesta en el comportamiento del nitroprusiato :
Algunos complejos aniónicos de nitrito se someten a desoxigenación inducida por ácido para dar el complejo de nitrosilo . [11]
La reacción es reversible en algunos casos. Por lo tanto, se pueden generar complejos de nitrito mediante hidrólisis básica de nitrosilos de metales electrófilos.
Los complejos nitro también catalizan la oxidación de alquenos. [12]
Los complejos de nitrito metálico ocupan un lugar destacado en el ciclo del nitrógeno , que describe las relaciones e interconversiones del amoníaco hasta el nitrato . Debido a que el nitrógeno suele ser un nutriente limitante, este ciclo es importante. El nitrito en sí no sufre fácilmente reacciones redox, pero sus complejos metálicos sí. [13]
La enzima nitrito oxidorreductasa que contiene molibdeno cataliza la oxidación de nitrito a nitrato:
La enzima nitrito reductasa basada en hemo cataliza la conversión de nitrito en amoníaco. El ciclo comienza con la reducción de un complejo de nitrito de hierro a un complejo de nitrosilo metálico . [3]
La enzima nitrito reductasa (CuNIR) que contiene cobre cataliza la reducción de 1 electrón del nitrito a óxido nítrico. El mecanismo propuesto implica la protonación de un complejo κ 2O,O -NO 2 -Cu(I). Esta protonación induce la escisión de un enlace N – O, dando un centro HO – Cu – ON, que presenta un ligando de óxido nítrico unido O a Cu (II) (un isonitrosilo ).