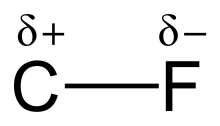
El enlace carbono-flúor es un enlace covalente polar entre el carbono y el flúor que es un componente de todos los compuestos organofluorados . Es uno de los enlaces simples más fuertes en química (después del enlace simple B-F , el enlace simple Si-F y el enlace simple H-F), y relativamente corto, debido a su carácter iónico parcial . El enlace también se fortalece y se acorta a medida que se agregan más flúor al mismo carbono en un compuesto químico . Como tal, los fluoroalcanos como el tetrafluorometano (tetrafluoruro de carbono) son algunos de los compuestos orgánicos menos reactivos .
La alta electronegatividad del flúor (4,0 para el flúor frente a 2,5 para el carbono) proporciona al enlace carbono-flúor una polaridad o momento dipolar significativo . La densidad electrónica se concentra alrededor del flúor, lo que deja al carbono relativamente pobre en electrones. Esto introduce un carácter iónico al enlace a través de cargas parciales (C δ+ —F δ− ). Las cargas parciales del flúor y el carbono son atractivas, lo que contribuye a la inusual fuerza de enlace del enlace carbono-flúor. El enlace se etiqueta como "el más fuerte en química orgánica", [1] porque el flúor forma el enlace simple más fuerte con el carbono. Los enlaces carbono-flúor pueden tener una energía de disociación de enlace (BDE) de hasta 130 kcal/mol. [2] La BDE (fuerza del enlace) de C–F es mayor que otros enlaces carbono- halógeno y carbono- hidrógeno . Por ejemplo, los BDE del enlace C–X dentro de una molécula CH3 – X son 115, 104,9, 83,7, 72,1 y 57,6 kcal/mol para X = flúor, hidrógeno , cloro , bromo y yodo , respectivamente. [3]
La longitud del enlace carbono-flúor es típicamente de alrededor de 1,35 ångström (1,39 Å en fluorometano ). [1] Es más corto que cualquier otro enlace carbono-halógeno, y más corto que los enlaces carbono- nitrógeno y carbono -oxígeno simples . La corta longitud del enlace también puede atribuirse al carácter iónico del enlace (las atracciones electrostáticas entre las cargas parciales en el carbono y el flúor). La longitud del enlace carbono-flúor varía en varias centésimas de ångstrom dependiendo de la hibridación del átomo de carbono y la presencia de otros sustituyentes en el carbono o incluso en átomos más alejados. Estas fluctuaciones pueden usarse como indicación de cambios sutiles de hibridación e interacciones estereoelectrónicas . La siguiente tabla muestra cómo varía la longitud de enlace promedio en diferentes entornos de enlace (los átomos de carbono están hibridados sp 3 a menos que se indique lo contrario para sp 2 o carbono aromático).
La variabilidad en las longitudes de enlace y el acortamiento de los enlaces con flúor debido a su carácter iónico parcial también se observan para enlaces entre flúor y otros elementos, y han sido una fuente de dificultades con la selección de un valor apropiado para el radio covalente del flúor . Linus Pauling sugirió originalmente 64 pm , pero ese valor fue finalmente reemplazado por 72 pm, que es la mitad de la longitud del enlace flúor-flúor. Sin embargo, 72 pm es demasiado largo para ser representativo de las longitudes de los enlaces entre flúor y otros elementos, por lo que otros autores han sugerido valores entre 54 pm y 60 pm. [5] [6] [7] [8]
A medida que aumenta el número de átomos de flúor en el mismo carbono ( geminal ), los demás enlaces se vuelven más fuertes y más cortos. Esto se puede ver por los cambios en la longitud y fuerza de enlace (BDE) para la serie del fluorometano, como se muestra en la tabla siguiente; también, las cargas parciales ( q C y q F ) en los átomos cambian dentro de la serie. [2] La carga parcial en el carbono se vuelve más positiva a medida que se agregan flúor, lo que aumenta las interacciones electrostáticas y el carácter iónico entre los flúor y el carbono.

Cuando dos átomos de flúor están en carbonos vecinales (es decir, adyacentes), como en el 1,2-difluoroetano (H 2 FCCFH 2 ), el confórmero gauche es más estable que el confórmero anti; esto es lo opuesto a lo que normalmente se esperaría y a lo que se observa para la mayoría de los etanos 1,2-disustituidos; este fenómeno se conoce como el efecto gauche . [9] En el 1,2-difluoroetano, la conformación gauche es más estable que la conformación anti en 2,4 a 3,4 kJ/mol en la fase gaseosa. Sin embargo, este efecto no es exclusivo del flúor halógeno ; el efecto gauche también se observa para el 1,2-dimetoxietano . Un efecto relacionado es el efecto cis del alqueno . Por ejemplo, el isómero cis del 1,2-difluoroetileno es más estable que el isómero trans. [10]
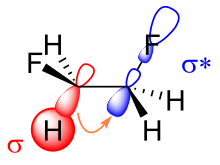
Existen dos explicaciones principales para el efecto gauche: hiperconjugación y enlaces doblados . En el modelo de hiperconjugación, la donación de densidad electrónica del orbital de enlace σ carbono-hidrógeno al orbital antienlazante σ * carbono-flúor se considera la fuente de estabilización en el isómero gauche. Debido a la mayor electronegatividad del flúor, el orbital σ carbono-hidrógeno es un mejor donante de electrones que el orbital σ carbono-flúor, mientras que el orbital σ * carbono-flúor es un mejor aceptor de electrones que el orbital σ * carbono-hidrógeno . Solo la conformación gauche permite una buena superposición entre el mejor donante y el mejor aceptor. [11]
La clave para explicar el efecto gauche en el difluoroetano es el aumento del carácter orbital p de ambos enlaces carbono-flúor debido a la gran electronegatividad del flúor. Como resultado, la densidad electrónica aumenta por encima y por debajo, a la izquierda y a la derecha del enlace carbono-carbono central. La superposición orbital reducida resultante se puede compensar parcialmente cuando se supone una conformación gauche, formando un enlace doblado. De estos dos modelos, la hiperconjugación se considera generalmente la causa principal detrás del efecto gauche en el difluoroetano. [1] [12]
El estiramiento del enlace carbono-flúor aparece en el espectro infrarrojo entre 1000 y 1360 cm −1 . El amplio rango se debe a la sensibilidad de la frecuencia de estiramiento a otros sustituyentes en la molécula. Los compuestos monofluorados tienen una banda fuerte entre 1000 y 1110 cm −1 ; con más de un átomo de flúor, la banda se divide en dos bandas, una para el modo simétrico y otra para el asimétrico. [13] Las bandas carbono-flúor son tan fuertes que pueden oscurecer cualquier banda carbono-hidrógeno que pueda estar presente. [14]
Los compuestos organofluorados también pueden caracterizarse mediante espectroscopia de RMN , utilizando carbono-13 , flúor-19 (el único isótopo natural del flúor) o hidrógeno-1 (si está presente). Los desplazamientos químicos en la RMN de 19 F aparecen en un rango muy amplio, dependiendo del grado de sustitución y del grupo funcional. La siguiente tabla muestra los rangos para algunas de las clases principales. [15]
La ruptura de enlaces C–F es de interés como una forma de descomponer y destruir los organofluorados " químicos para siempre " como el PFOA y los compuestos perfluorados (PFC). Los métodos candidatos incluyen catalizadores, como átomos de platino; [16] fotocatalizadores; UV, yoduro y sulfito, [17] radicales; etc.
Algunos complejos metálicos rompen enlaces CF. Estas reacciones son de interés desde la perspectiva de la síntesis orgánica y la remediación de sustancias xenoquímicas. [18] La activación del enlace CF se ha clasificado de la siguiente manera: "(i) adición oxidativa de fluorocarbono, (ii) formación de enlace M–C con eliminación de HF, (iii) formación de enlace M–C con eliminación de fluorosilano, (iv) hidrodesfluoración de fluorocarbono con formación de enlace M–F, (v) ataque nucleofílico al fluorocarbono y (vi) desfluoración de fluorocarbono". Una reacción ilustrativa de activación de CF mediada por metales es la desfluoración de fluorohexano por un dihidruro de zirconoceno :