
El cáliz de Held es una sinapsis excitatoria particularmente grande en el sistema nervioso auditivo de los mamíferos , llamada así por Hans Held, quien la describió por primera vez en su artículo de 1893 Die centrale Gehörleitung [1] [2] debido a su parecido con el cáliz de una flor. [3] Las células tupidas globulares en el núcleo coclear anteroventral (AVCN) [4] envían axones al núcleo medial contralateral del cuerpo trapezoidal (MNTB), donde hacen sinapsis a través de estos cálices en las células principales del MNTB. [5] [6] [7] Estas células principales luego se proyectan a la oliva superior lateral ipsilateral (LSO) , [8] donde inhiben las neuronas postsinápticas y proporcionan una base para la detección del nivel interaural (ILD), necesaria para la localización del sonido de alta frecuencia. [9] Esta sinapsis ha sido descrita como la más grande del cerebro. [10]
El bulbo terminal relacionado de Held también es una gran sinapsis terminal axónica (de 15 a 30 μm de diámetro) que se encuentra en otra estructura del tronco encefálico auditivo, a saber, el núcleo coclear anteroventral (AVCN). [11] Al igual que con los cálices, estas sinapsis promueven una transferencia de información rápida y eficiente.
El cáliz y el bulbo terminal de Held contienen vesículas que contienen glutamato en la terminal presináptica; las vesículas se liberan tras la estimulación (que se origina en la cóclea y el AVCN). El glutamato se une entonces a dos receptores de glutamato conocidos, los receptores AMPA y NMDA , lo que inicia rápidamente potenciales de acción en la célula postsináptica. [12]
Comúnmente utilizado en investigación debido a su gran tamaño, el cáliz de Held se ha utilizado para comprender una variedad de mecanismos relacionados con el desarrollo y la liberación de vesículas de la sinapsis.
El cáliz de Held es una parte del sistema auditivo , que conecta las células tupidas globulares (GBC) del núcleo coclear anteroventral a las neuronas principales del núcleo medial del cuerpo trapezoide (MNTB). Como sinapsis, la función del cáliz de Held es transmitir la señal de las GBC a las neuronas principales del MNTB, que son glicinérgicas, hiperpolarizando así las células en los núcleos de la oliva superior lateral (LSO) y produciendo efectos inhibidores. [12] Como resultado de su papel en la estimulación de las neuronas principales del MNTB, la función principal del cáliz de Held es permitir la diferenciación entre la activación temporal de las células ciliadas cocleares que son importantes en la localización del sonido (detección del nivel interaural). [13]
La detección del nivel interaural es posible a través del sistema del cáliz debido al gran tamaño relativo de las GBC, el cáliz de Held y las neuronas principales del MNTB. Las neuronas del LSO son especialmente importantes para discernir estas diferencias de nivel interaural. El gran diámetro de los axones de las células tupidas permite que la señal inhibidora producida por las neuronas del MNTB llegue al SOC aproximadamente 0,2 ms más tarde que la excitación ipsilateral. Esta diferencia de retardo de tiempo de ~0,2 milisegundos es lo suficientemente corta como para permitir la comparación de los niveles de los dos lados para evaluar la ILD, especialmente a frecuencias altas, y también permite cierta sensibilidad de la ITD, a frecuencias lo suficientemente bajas como para tener un bloqueo de fase ciclo a ciclo. [12]

Por cada neurona principal de la MNTB hay un cáliz, y para la mayoría de los axones de las GBC hay un solo cáliz, aunque hay excepciones a este emparejamiento. [1] En general, esto crea una relación de uno a uno entre las GBC, los cálices de Held y las neuronas principales. El cáliz de Held abarca la neurona principal con una morfología distinta: la ramificación del cáliz permite la creación de redes de segundo y tercer orden. Cada ramificación establece una conexión con la neurona principal, lo que genera una gran cantidad de zonas activas. Esto es inusual para las terminales sinápticas del cerebro, ya que la mayoría crea una sola zona activa. [14] Cada cáliz contiene entre 300 y 700 zonas activas, y en cada una de las zonas activas hay alrededor de 100 vesículas que contienen glutamato con aproximadamente 3 vesículas acopladas a la vez. Estas vesículas son grandes, lo que coincide con los hallazgos sobre el tamaño cuántico en otras sinapsis adultas. También están presentes vesículas de núcleo denso, que generalmente contienen neuropéptidos , pero se necesitan más investigaciones para determinar su contenido y función. [15]
Para mantener la estructura de la sinapsis, al igual que ocurre con otras sinapsis, existen numerosos microtúbulos . El cáliz tiene una gran cantidad de microtúbulos en la base de la terminal. Estos microtúbulos llevan a cabo diversas funciones, como proporcionar estabilidad a la sinapsis, restringir la distribución de las vesículas sinápticas y localizar las mitocondrias . Las mitocondrias tienen tres funciones importantes en la terminal sináptica: permitir que la sinapsis satisfaga las necesidades metabólicas (especialmente para la eliminación de calcio después de la despolarización ), amortiguar el calcio permitiendo la absorción de calcio en las mitocondrias y proporcionar energía para la síntesis de glutamato. [12]
Varias células gliales también están asociadas con el cáliz de Held. Dos tipos de células gliales rodean el cáliz: astrocitos y células gliales NG 2 . Los astrocitos expresan transportadores de glutamato para eliminar el glutamato de la sinapsis. Este es el único mecanismo conocido para la eliminación del glutamato de la sinapsis. Las células gliales NG 2 expresan receptores AMPA. [12]
En el segundo día postnatal (P2), se forma el cáliz inmaduro de Held en rata, que se distingue fácilmente por su característica morfología en cuchara sellada . [12] Los contactos sinápticos primarios que forman el cáliz se ensamblan entre neuronas del MNTB (núcleo medial del cuerpo trapezoidal) y VCN (nervio coclear ventral), y finalmente se conectan entre sí al proyectarse a través de la línea media de las dos áreas. Estas asociaciones comienzan a aparecer inmediatamente después de que se hayan generado las neuronas VCN; se puede observar la formación más temprana de estos contactos alrededor del día embrionario 17 (E17). Estas conexiones neuronales, que conforman un área importante de la cóclea, forman ramas entre sí que terminan en el cáliz de Held. En el transcurso de las siguientes dos a tres semanas, los contactos neuronales que primero formaron el cáliz embrionario evolucionan en forma y función, culminando en un cáliz maduro que facilita la propagación constante y rápida de señales en el área MNTB-VCN. [14]
Unos pocos procesos selectos ocurren durante el desarrollo neuronal temprano para asegurar la formación adecuada del cáliz, específicamente a través de la influencia del factor de crecimiento fibroblástico (FGF), el factor de transcripción Math5, la molécula de reconocimiento de células neuronales NB-2 y las proteínas efrina (Eph) en las células. Math1/Math5 y FGF son dos reguladores esenciales para el crecimiento y desarrollo adecuados del complejo del núcleo coclear , que comprende tanto el núcleo coclear ventral (VCN) como el núcleo coclear dorsal (DCN). Los niveles suficientes de FGF aseguran la morfología adecuada de los núcleos cocleares, mientras que Math5 asegura el tamaño y procesamiento correctos del núcleo coclear. Math1, otro factor de transcripción, es necesario para la aparición de neuronas VCN en la corriente extramural coclear, así como las neuronas del complejo olivar superior . NB-2 también ayuda en el avance de la formación del cáliz de Held, además de contribuir al mantenimiento del MNTB contralateral. Los efectos combinados de estas tres moléculas entre sí ilustran el hecho de que hay muchas familias de proteínas involucradas en la señalización y formación adecuadas del cáliz. [14]
Además, las proteínas Eph son fundamentales para el desarrollo posterior del sistema de circuitos auditivos después de la formación inicial del cáliz embrionario. Una característica que distingue a las proteínas Eph y sus receptores de otros sistemas de señalización es su capacidad de transmitir información de forma bidireccional. La señalización directa e inversa en las células VCN y MNTB es esencial para la cantidad y formación adecuadas de proyecciones VCN y MNTB ipsilaterales en el cáliz. Las proteínas Eph también garantizan que, mientras los axones pasan a través del MNTB ipsilateral, la ramificación y la terminación final de estas proyecciones solo se produzcan en el MNTB contralateral, posiblemente porque las proteínas solo se dirigen a regiones específicas de los axones. [14]
En general, se producen dos cambios ultraestructurales en el cáliz de Held. El primero es que en la segunda semana de desarrollo aumenta la mielinización de los axones del VCN en el MNTB. Este importante crecimiento de la mielina corresponde al desarrollo cronológico del circuito de señalización y la adaptación del cáliz. El segundo cambio ultraestructural afecta a las neuronas principales de los MNTB, cuyos cuerpos celulares y núcleos aumentan su superficie debido al agrandamiento. Esto es un resultado directo de la fragmentación de las densidades postsinápticas individuales más grandes en densidades múltiples más pequeñas. [14]

Los canales de potasio son vitales para conducir el potencial de acción presináptico . El cáliz contiene varios tipos de canales de potasio, cada uno de ellos con una ubicación y una sensibilidad diferentes. En las neuronas presinápticas están presentes tanto canales de K + de umbral bajo como canales de K + de tipo rectificador retardado de umbral alto . [15] Hay cuatro canales de K + de umbral bajo presentes: K v 1.1, K v 1.2, K v 1.3 y K v 7.5. K v 1.1 y K v 1.2 se encuentran en la zona de transición entre el axón y la terminal, mientras que K v 1.3 y K v 7.5 se encuentran en el cáliz. [15] Hay un canal de potasio activado por calcio expresado en el cáliz, sin embargo, este tipo de canal no contribuye a la liberación de neurotransmisores. [12]
En el lapso de una semana, los sujetos ratones (P7 a P14) mostraron que la densidad de los canales de umbral bajo K v 1 y K v 3 aumenta, lo que a su vez afecta la cinética de los canales. [15]
Los cambios en los canales de sodio durante la maduración permiten una mayor velocidad del potencial de acción presináptico. Aquí, los potenciales de acción se vuelven más rápidos debido a la capacidad de los canales de sodio de recuperarse más rápido después de la conducción . La evidencia muestra que la expresión en la subunidad alfa de Na V 1.6 , un tipo específico de canal de sodio, es responsable de la mayor velocidad en la transmisión. Se sabe que Na V 1.2 , otro canal de sodio expresado en los axones y los nodos, exhibe una cinética más lenta. [14]
Para compensar la mielinización (mayor capacitancia ), el camino hasta el cáliz en el último nodo (el área entre la vaina de mielina) antes de la terminal del axón contiene una alta densidad de canales de Na + para permitir que una gran afluencia (flujo entrante) de sodio active los canales de calcio dependientes de voltaje para abrirlos en la terminal presináptica, lo que provoca una entrada de calcio.
En los cálices inmaduros de Held, los iones de calcio (Ca 2+ ) ingresan a las neuronas MNTB a través de los canales de Ca 2+ de tipo N , P/Q y R , pero en los cálices maduros, la entrada de Ca 2+ ocurre principalmente a través de los canales de tipo P/Q. [14] Los receptores de Ca 2+ de tipo N y R son menos propensos a desencadenar la liberación de vesículas, ya que estos tipos de receptores están más alejados de los sitios de liberación. Por lo tanto, los iones de calcio que ingresan a los canales de tipo N y R aumentan la concentración de iones de calcio en áreas de menor importancia para la función del cáliz.
El bloqueo de los canales de Ca 2+ puede ocurrir mediante el uso de receptores acoplados a proteína G , activados por los siguientes neurotransmisores: [12]
Se producen cambios en los canales iónicos para favorecer una transmisión más rápida: [12]
Aparte del receptor de glutamato, sólo se han encontrado otros pocos canales regulados por ligando en los cálices inmaduros de Held: el receptor ionotrópico GABA A y el receptor de glicina . Estos receptores permiten que el cloruro (Cl − ) fluya a través de la membrana y, debido a la alta concentración de cloruro en la terminal, estos receptores son despolarizantes. [12]
Entre la segunda y tercera semanas posnatales, cerca del momento del inicio de la audición, el cáliz de Held desarrolla su característica apariencia altamente fenestrada (muchas aberturas). [14] La fenestración da como resultado que la membrana se reduzca a numerosos compartimentos pequeños, lo que aumenta la relación superficie-volumen del cáliz de Held. A medida que la membrana se estrecha cada vez más en estas estructuras similares a bulbos, las vesículas sinápticas se agrupan aún más en estos espacios, lo que da como resultado un mayor número de vesículas acopladas. [12]
Para compensar los espacios disponibles en el cáliz, se utilizan células gliales con receptores y transportes de glutamato para llenar los espacios abiertos, asegurando una captación eficiente de glutamato en la sinapsis.
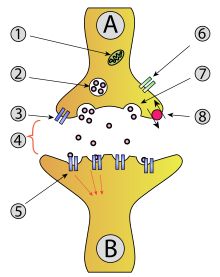
Como sinapsis, el cáliz de Held sigue un mecanismo similar al de otras sinapsis. Se puede encontrar una descripción detallada en el apartado de neurotransmisión .
La entrada de calcio al cáliz inmaduro de Held está mediada por canales de calcio de tipo N , P / Q y R ; sin embargo, tras la maduración, solo los canales de calcio de tipo P/Q se vuelven dominantes. [14] Tras la entrada de calcio, el cáliz inmaduro de Held es muy reactivo debido a su pequeña capacidad de amortiguación de calcio ; esto provoca la liberación de glutamato incluso a bajos niveles de entrada de calcio. Dentro de la terminal, al igual que con otras sinapsis, dos iones de calcio se unen a la sinaptotagmina para desencadenar la liberación de vesículas; en el caso de los cálices de Held, el glutamato se libera en las vesículas. Además de la liberación de vesículas, los iones de calcio envían señales a la terminal del cáliz para que vuelva al estado inactivo. Tras la entrada de calcio, se fosforila una proteína de unión al elemento de respuesta al AMPc (CREB) , lo que altera las concentraciones de potasio dentro de la célula para devolver la terminal a un estado inactivo. [14] La eliminación del calcio se realiza a través de varios métodos, entre ellos: su eliminación desde la terminal, su incorporación a las mitocondrias o su unión a proteínas que se unen al calcio, como la parvalbúmina y la calretinina . [12]
La señalización retrógrada es necesaria en el cáliz de Held para regular los niveles de calcio dentro de la terminal presináptica. La activación de los receptores metabotrópicos de glutamato (mGluR) activa un mensajero secundario de proteína G que interactúa con los canales de calcio de tipo P/Q para disminuir la conductancia. Además, aumenta el tamaño del conjunto de vesículas y disminuye la probabilidad de liberación. Otros métodos de inhibición presináptica incluyen noradrenalina, serotonina y adenosina; estos métodos solo se observan en cálices de Held inmaduros. [14]
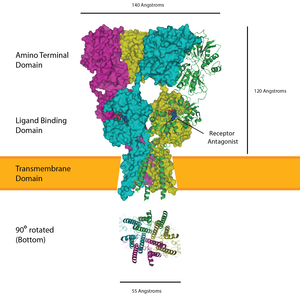
Los receptores de glutamato están presentes en la terminal postsináptica; los dos tipos incluyen receptores ionotrópicos AMPA y NMDA . Como neurotransmisor excitatorio, el glutamato casi siempre provoca que se active un potencial de acción en el lado postsináptico, estimulado además por el bajo sodio interno de las neuronas principales. [12] En el cáliz maduro, los receptores AMPA se concentran en la neurona principal para localizar la transmisión y lograr una mayor probabilidad de potencial de acción. También hay que tener en cuenta que las contribuciones de los receptores de glutamato de tipo NMDA disminuyen después del inicio de la audición. [12]
El mecanismo de endocitosis de vesículas sinápticas cambia a medida que el cáliz se vuelve más maduro. La calmodulina y la calcineurina en su forma activa son necesarias para la endocitosis de vesículas en un cáliz inmaduro; sin embargo, en el cáliz maduro no son necesarias ni la calmodulina ni la calcineurina. Más bien, el proceso está mediado por la energía creada por la hidrólisis de GTP. [14] Para cargar el glutamato en vesículas en la terminal se utilizan dos proteínas: el transportador de glutamato vesicular 1 (VGLUT1) y VGLUT2.
Los canales de potasio de umbral alto en la membrana postsináptica permiten una rápida repolarización de la neurona objetivo. Los canales de potasio de umbral bajo de la neurona postsináptica reducen la excitabilidad de la neurona para restringir su activación únicamente a las entradas sinápticas más grandes. [ 12]
El cáliz de Held se ha convertido en un sistema modelo popular en el campo de la neurobiología. La presencia de esta sinapsis en el sistema nervioso de los mamíferos ha permitido la investigación directa dentro de un modelo de mamífero y su gran tamaño facilita el registro electrofisiológico . Por estas razones, ha sido popular para comprender la liberación de transmisores.
En concreto, el cáliz de Held se utiliza por: [12]