Una batería de radicales orgánicos (ORB) es un tipo de batería desarrollada por primera vez en 2005. [1] A partir de 2011, este tipo de batería generalmente no estaba disponible para el consumidor, aunque su desarrollo en ese momento se consideró que se acercaba al uso práctico. [2] Las ORB son potencialmente más respetuosas con el medio ambiente que las baterías convencionales basadas en metales , porque utilizan polímeros de radicales orgánicos (plásticos flexibles) para proporcionar energía eléctrica en lugar de metales. Las ORB se consideran una alternativa de alta potencia a la batería de iones de litio . Diferentes grupos de investigación y corporaciones, incluida la corporación japonesa NEC , han investigado y desarrollado prototipos funcionales de la batería . [1]
Los polímeros radicales orgánicos utilizados en los ORB son ejemplos de radicales estables , que se estabilizan mediante efectos estéricos y/o de resonancia . [2] Por ejemplo, el radical nitróxido en (2,2,6,6-tetrametilpiperidin-1-il)oxilo (TEMPO), la subunidad más común utilizada en los ORB, es un radical molecular estable centrado en el oxígeno. Aquí, el radical se estabiliza mediante la deslocalización de electrones del nitrógeno al oxígeno. Los radicales TEMPO se pueden unir a las cadenas principales de polímeros para formar poli(metacrilato de 2,2,6,6-tetrametil-piperidiniloxilo-4-ilo) (PTMA). Los ORB basados en PTMA tienen una densidad de carga ligeramente superior a la de las baterías de iones de litio convencionales , lo que teóricamente debería permitir que un ORB proporcione más carga que una batería de iones de litio de tamaño y peso similares. [2]
A partir de 2007, la investigación ORB se dirigió principalmente hacia las baterías híbridas ORB/Li-ion porque los polímeros radicales orgánicos con propiedades eléctricas apropiadas para el ánodo son difíciles de sintetizar. [3]
En 2015, los ORB todavía estaban en desarrollo y no se utilizaban comercialmente. [ cita requerida ] En teoría, los ORB podrían reemplazar a las baterías de iones de litio como baterías más respetuosas con el medio ambiente con una capacidad de carga similar o mayor y un tiempo de carga similar o más corto. [2] Esto haría que los ORB fueran adecuados para dispositivos electrónicos portátiles.
Las baterías de radicales orgánicos fueron investigadas y desarrolladas por primera vez por NEC en 2005 con la intención de que se usaran ampliamente para alimentar dispositivos pequeños en un futuro cercano. [1] Comenzaron con un tamaño de 0,3 mm y un tiempo de carga extremadamente rápido. Desde el comienzo del desarrollo, las tarjetas inteligentes y las etiquetas RFID fueron los principales objetivos para el uso de ORB. [4] NEC también ha trabajado en una batería más grande de 0,7 mm que es más gruesa, pero también tiene una alta capacidad de carga de 5 mAh. [5]
Dada la rápida química redox de los radicales de nitróxido, [2] se ha demostrado que los ORB son útiles para mantener una computadora en funcionamiento momentáneamente después de un corte de energía. Aunque la cantidad de tiempo adicional que proporcionan es breve, es suficiente para permitir que una computadora haga una copia de seguridad de los datos cruciales antes de apagarse por completo. [1]
Las baterías de polímeros radicales dependen de una reacción redox de un radical orgánico para generar un potencial electroquímico . El ejemplo más estudiado de una reacción redox de radicales orgánicos es el de los radicales nitróxido, como el que se encuentra en una molécula llamada (2,2,6,6-Tetrametilpiperidin-1-il)oxilo , también conocida como TEMPO. Un radical nitróxido puede oxidarse a un catión oxamonio o reducirse a un anión hidroxilamina.


El electrodo positivo utiliza el par redox del catión nitróxido-oxamonio para crear un potencial electroquímico , es decir, cuando la batería se descarga, el radical nitróxido se oxida al catión oxamonio y cuando la batería se carga, el catión oxamonio se reduce nuevamente al nitróxido. Los potenciales redox para el nitróxido muestran alguna variación y para el nitróxido TEMPO para este par redox tiene un potencial de oxidación de +0,87 V. El electrodo positivo a menudo toma la forma de un gel hecho de sólidos radicales orgánicos y grafito , permeado con electrolitos. [1] El grafito se mezcla con el polímero para aumentar la conductividad. [6]
El electrodo negativo utiliza el par redox nitróxido-anión hidroxilamina para crear un potencial electroquímico, es decir, cuando la batería se descarga, el radical nitróxido se reduce al anión hidroxilamina y cuando la batería se carga, el anión hidroxilamina se oxida de nuevo al nitróxido. Esta semirreacción tiene un potencial de oxidación de -0,11 V. Dado que esta semirreacción no es fácilmente reversible como la semirreacción en el electrodo positivo, varios grupos de investigación han dejado de utilizar baterías de radicales orgánicos puros y, en su lugar, utilizan baterías híbridas de metal/ORB que suelen constar de un cátodo de polímero radical y el mismo ánodo que se encuentra en las baterías recargables de iones de litio . [2] [3] [7]
Al igual que una batería tradicional , como una batería de iones de litio , una batería de radicales orgánicos consta de un cátodo y un ánodo que están separados por una película porosa y sumergidos en un electrolito. En una batería de radicales orgánicos puros, ambos terminales están hechos de polímeros de radicales orgánicos (un polímero de tipo p y un polímero de tipo n), mientras que una batería híbrida de metal/ORB generalmente tiene un cátodo de polímero radical y un ánodo de iones de litio/grafito. [8]
Se han utilizado varios métodos sintéticos en la síntesis de especies polirradicales para su uso en baterías de radicales orgánicos. Los siguientes métodos se han utilizado para sintetizar poli(2,2,6,6-tetrametilpiperidiniloxi-4-il metacrilato) (PTMA) y otros polímeros de nitróxido.
Los primeros intentos de sintetizar PTMA implicaron sintetizar el polímero sin funcionalidad radicalaria mediante polimerización por radicales libres . Una vez sintetizado el polímero, la función nitróxido se puede introducir mediante oxidación. [3]
Varios grupos han descrito la síntesis de PTMA (4) utilizando polimerización por radicales libres de metacrilato de 2,2,6,6-tetrametilpiperidina (2) con 2,2'-azobisiobutryonitrilo ( AIBN ) como iniciador radical. El monómero se preparó a través de 2,2,6,6-tetrametil-4-piperidinol (1) y cloruro de metacriloilo . El polímero neutro precursor (3) se oxidó al polímero radical estable (4) mediante ácido 3-cloroperoxibenzoico (mCPBA). [9] [10] Se han propuesto enfoques sintéticos similares utilizando 4-metacriloiloxi-N-hidroxi-2,2,6,6-tetrametilpiperidina como monómero en lugar de metacrilato de 2,2,6,6-tetrametilpiperidina. [11]

La polimerización por radicales libres como método sintético presenta varios inconvenientes. La limitación más relevante es el hecho de que la oxidación del polímero precursor nunca llega al 100%. Como resultado, el PTMA sintetizado tiene entre el 65% y el 81% de la cantidad teóricamente posible de grupos nitróxido. La disminución del número de grupos nitróxido afecta negativamente la capacidad de carga del polímero y limita su eficacia en baterías de radicales orgánicos. [3] No solo hay menos grupos nitróxido presentes, sino que también las reacciones secundarias entre los grupos no oxidados y los cationes oxamonio disminuyen la reversibilidad redox del compuesto.
Las dificultades de la polimerización por radicales libres del PTMA podrían evitarse si no fuera necesario el paso de oxidación. Sin embargo, debido a que los radicales nitróxido reaccionarían con cualquier radical de carbono formado durante la polimerización, el uso de un monómero con un radical nitróxido no es práctico. [3]
Una de las técnicas más recientes identificadas para sintetizar PTMA es un tipo de polimerización por radicales libres conocida como polimerización por transferencia de cadena por adición-fragmentación reversible (RAFT). [12]

La polimerización de PTMA mediada por RAFT utiliza el mismo monómero de partida que la polimerización por radicales libres. El uso del método mediado por RAFT para polimerizar metacrilato de 2,2,6,6-tetrametil-4-piperidinilo (TMPM), el monómero de partida, genera poli(metacrilato de 2,2,6,6-tetrametil-4-piperidinilo) o PTMPM-RAFT. La oxidación directa de PTMPM-RAFT a PTMA no es práctica, ya que la oxidación directa provoca reacciones secundarias que involucran al grupo terminal tiocaroniltiol de PTMPM-RAFT para reaccionar y formar un producto insoluble similar a un gel. En cambio, se utiliza un exceso de AIBN para eliminar el extremo reactivo y formar PTMPM, que luego puede oxidarse con ácido metacloroperbenzoico al PTMA deseado. [12]
A pesar de la promesa de la polimerización mediada por RAFT, la concentración de radicales informada fue solo del 69 ± 4%. [12]
La polimerización catalizada por rodio de monómeros que contienen TEMPO evita algunos de los desafíos que plantea la polimerización por radicales libres porque no se necesita un paso de oxidación para generar el radical.
La estructura de (2,2,6,6-Tetrametilpiperidina-1-il)oxilo o TEMPO se muestra a continuación.

Los siguientes monómeros (1-3) se pueden sintetizar mediante una reacción de condensación entre grupos carboxilo con el grupo amino o hidroxilo de derivados de acetileno y varios derivados de TEMPO. La polimerización de los monómeros se completa utilizando un catalizador de rodio (nbd)Rh + [n 6 -C 6 H 5 B − (C 6 H 5 ) 3 ]. [8] La síntesis catalizada por rodio de polímeros que contienen TEMPO se ha realizado con un alto rendimiento cuantitativo.

Si bien el uso de un catalizador de rodio puede ser ventajoso debido a su alto rendimiento, el uso de un catalizador de metal presenta el desafío adicional de tener que separar el catalizador del producto final. [12]
La polimerización aniónica directa de monómeros que contienen nitroxilo también se ha utilizado para sintetizar PTMA. La polimerización aniónica no es ideal porque debe llevarse a cabo utilizando procedimientos muy estrictos para evitar reacciones secundarias. El uso de 1,1-difenilhexil-litio como iniciador de la reacción elimina algunas reacciones secundarias por efectos estéricos, [13] sin embargo, los procedimientos necesarios no son aptos para la síntesis a gran escala. [3]
La polimerización por transferencia de grupo, al igual que la polimerización de PTMA catalizada por rodio, permite la polimerización de monómeros de radicales nitroxilo. A diferencia de los monómeros catalizados por rodio, la polimerización por transferencia de grupo utiliza silicio para catalizar la polimerización.
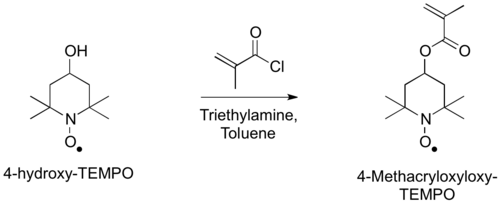
La preparación del monómero, 4-metacriloxiloxi-TEMPO, se puede lograr mediante la acilación de 4-hidroxi-TEMPO con cloruro de metacriloilo. [3]

La polimerización con 1-metoxi-2-metil-1-trimetilsililoxi-propeno (MTS) como catalizador se lleva a cabo rápidamente a temperatura ambiente para formar PTMA. El fluoruro de tetrabutilamonio (TBAF) se utiliza como catalizador adicional.
A continuación se presenta una justificación para la polimerización por transferencia de grupo.

Las baterías de radicales orgánicos son mucho más respetuosas con el medio ambiente que las baterías de iones de litio , ya que no contienen metales que planteen problemas a la hora de desecharlas correctamente. Las baterías de radicales orgánicos no son tóxicas ni inflamables y no requieren cuidados adicionales al manipularlas. [1] La combustión de polímeros de radicales de nitróxido produce dióxido de carbono, agua y óxido de nitrógeno sin cenizas ni olor. [6]
Si bien son amigables con el medio ambiente, tienen propiedades que son comparables a las baterías de iones de litio : los ORB tienen una capacidad teórica de 147 mA hg −1 , que es ligeramente superior a la de las baterías de iones de litio con 140 mA hg −1 . [2] Los ORB también muestran tiempos de carga comparables y retienen bien la capacidad de carga-descarga, igualando a las baterías de iones de litio en el 75% de su carga inicial después de 500 ciclos. [14] Además, la concentración de radicales en los ORB es lo suficientemente estable en condiciones ambientales como para permanecer sin cambios durante más de un año. [6] Los ORB también son más flexibles que las baterías de iones de litio , lo que los haría más adaptables a diferentes restricciones de diseño, como los dispositivos curvos. [15]
Una de las principales dificultades en el desarrollo de los ORB es la dificultad de sintetizar un electrodo negativo adecuado. Esta desventaja surge porque la reacción redox del electrodo negativo no es totalmente reversible. Las baterías híbridas ORB/Li-ion, en las que el electrodo negativo se reemplaza por el que se encuentra en una batería de Li-ion , se han propuesto como un compromiso para superar esta dificultad. [2] [3]
Las reacciones de polimerización de monómeros estables que contienen radicales también han resultado ser un área de dificultad en el desarrollo. Los radicales orgánicos estables que son cruciales para el funcionamiento de la batería a veces se consumen en reacciones secundarias de varias reacciones de polimerización. Sin embargo, un grupo de investigación ha sintetizado con éxito un polímero de radicales orgánicos reticulados mientras que solo pierde el 0,4% de los radicales orgánicos en la síntesis del polímero. [3]