
El radio atómico de un elemento químico es una medida del tamaño de su átomo , generalmente la distancia media o típica desde el centro del núcleo hasta el electrón aislado más externo . Dado que el límite no es una entidad física bien definida, existen varias definiciones no equivalentes de radio atómico. Cuatro definiciones ampliamente utilizadas de radio atómico son: radio de Van der Waals , radio iónico , radio metálico y radio covalente . Por lo general, debido a la dificultad de aislar átomos para medir sus radios por separado, el radio atómico se mide en un estado químicamente enlazado; sin embargo, los cálculos teóricos son más simples cuando se consideran átomos de forma aislada. Las dependencias del entorno, la sonda y el estado conducen a una multiplicidad de definiciones.
Dependiendo de la definición, el término puede aplicarse a átomos en materia condensada , unidos covalentemente en moléculas , o en estados ionizados y excitados ; y su valor puede obtenerse mediante mediciones experimentales o calcularse a partir de modelos teóricos. El valor del radio puede depender del estado y el contexto del átomo. [1]
Los electrones no tienen órbitas definidas ni rangos claramente definidos. Más bien, sus posiciones deben describirse como distribuciones de probabilidad que se reducen gradualmente a medida que uno se aleja del núcleo, sin un corte abrupto; se las conoce como orbitales atómicos o nubes de electrones. Además, en la materia condensada y las moléculas, las nubes de electrones de los átomos suelen superponerse en cierta medida, y algunos de los electrones pueden vagar por una gran región que abarca dos o más átomos.
Según la mayoría de las definiciones, los radios de los átomos neutros aislados oscilan entre 30 y 300 pm ( billonésimas de metro), o entre 0,3 y 3 ångströms . Por lo tanto, el radio de un átomo es más de 10.000 veces el radio de su núcleo (1–10 fm ), [2] y menos de 1/1000 de la longitud de onda de la luz visible (400–700 nm ).
Para muchos propósitos, los átomos pueden modelarse como esferas. Esta es solo una aproximación rudimentaria, pero puede proporcionar explicaciones cuantitativas y predicciones para muchos fenómenos, como la densidad de líquidos y sólidos, la difusión de fluidos a través de tamices moleculares , la disposición de átomos e iones en cristales , y el tamaño y la forma de las moléculas . [ cita requerida ]
En 1920, poco después de que fuera posible determinar los tamaños de los átomos mediante cristalografía de rayos X , se sugirió que todos los átomos del mismo elemento tienen los mismos radios. [3] Sin embargo, en 1923, cuando se disponía de más datos sobre cristales, se descubrió que la aproximación de un átomo como una esfera no se cumple necesariamente cuando se compara el mismo átomo en diferentes estructuras cristalinas. [4]
Las definiciones ampliamente utilizadas del radio atómico incluyen:
La siguiente tabla muestra los radios covalentes medidos empíricamente para los elementos, según lo publicado por JC Slater en 1964. [9] Los valores están en picómetros (pm o 1×10 −12 m), con una precisión de aproximadamente 5 pm. El tono del recuadro varía de rojo a amarillo a medida que aumenta el radio; el gris indica falta de datos.
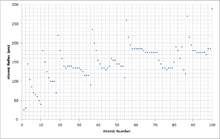
Los electrones de los átomos llenan las capas de electrones desde el nivel de energía más bajo disponible. Como consecuencia del principio de Aufbau , cada nuevo período comienza con los dos primeros elementos llenando el siguiente orbital s desocupado . Debido a que los electrones del orbital s de un átomo suelen estar más alejados del núcleo, esto da como resultado un aumento significativo del radio atómico con los primeros elementos de cada período.
El radio atómico de cada elemento generalmente disminuye a lo largo de cada período debido al aumento del número de protones, ya que un aumento en el número de protones aumenta la fuerza de atracción que actúa sobre los electrones del átomo. La mayor atracción acerca los electrones a los protones, lo que disminuye el tamaño del átomo. A medida que avanza en cada grupo, el radio atómico de cada elemento generalmente aumenta porque hay más niveles de energía de electrones ocupados y, por lo tanto, una mayor distancia entre protones y electrones.
La creciente carga nuclear se ve parcialmente contrarrestada por el creciente número de electrones (fenómeno conocido como apantallamiento ), lo que explica por qué el tamaño de los átomos suele aumentar en cada columna a pesar de un aumento de la fuerza de atracción del núcleo. El apantallamiento electrónico hace que la atracción del núcleo de un átomo sobre sus electrones disminuya, por lo que los electrones que ocupan estados de mayor energía más alejados del núcleo experimentan una fuerza de atracción reducida, lo que aumenta el tamaño del átomo. Sin embargo, los elementos del bloque 5d ( lutecio a mercurio ) son mucho más pequeños de lo que predice esta tendencia debido al débil apantallamiento de la subcapa 4f. Este fenómeno se conoce como contracción de los lantánidos . Existe un fenómeno similar para los actínidos ; sin embargo, la inestabilidad general de los elementos transuránicos dificulta las mediciones para el resto del bloque 5f y para los transactínidos, casi imposibles. Finalmente, para elementos suficientemente pesados, el radio atómico puede disminuir por efectos relativistas . [10] Esto es una consecuencia de que los electrones cerca del núcleo fuertemente cargado viajan a una fracción suficiente de la velocidad de la luz para ganar una cantidad no trivial de masa.
La siguiente tabla resume los principales fenómenos que influyen en el radio atómico de un elemento:
Los electrones en la subcapa 4f , que se llena progresivamente desde el lantano ( Z = 57) hasta el iterbio ( Z = 70), no son particularmente eficaces para proteger la carga nuclear creciente de las subcapas más alejadas. Los elementos inmediatamente posteriores a los lantánidos tienen radios atómicos que son más pequeños de lo que se esperaría y que son casi idénticos a los radios atómicos de los elementos inmediatamente superiores a ellos. [11] Por lo tanto, el lutecio es de hecho ligeramente más pequeño que el itrio , el hafnio tiene prácticamente el mismo radio atómico (y química) que el circonio , y el tántalo tiene un radio atómico similar al niobio , y así sucesivamente. El efecto de la contracción de los lantánidos es perceptible hasta el platino ( Z = 78), después de lo cual queda enmascarado por un efecto relativista conocido como el efecto del par inerte . [ cita requerida ]
Debido a la contracción de los lantánidos, se pueden extraer las cinco observaciones siguientes:
La contracción del bloque d es menos pronunciada que la contracción de los lantánidos, pero surge de una causa similar. En este caso, es la escasa capacidad de protección de los electrones 3d la que afecta a los radios atómicos y las químicas de los elementos inmediatamente posteriores a la primera fila de los metales de transición , desde el galio ( Z = 31) hasta el bromo ( Z = 35). [11]
La siguiente tabla muestra los radios atómicos calculados a partir de modelos teóricos, según lo publicado por Enrico Clementi y otros en 1967. [12] Los valores están en picómetros (pm).