En enzimología , una L-aminoácido oxidasa (LAAO) ( EC 1.4.3.2) es una enzima que cataliza la reacción química :
La enzima fue descrita por primera vez en 1944 por A. Zeller y A. Maritz. [1] Las LAAO no solo son bastante variables en términos de masa molecular, sino que también varían ampliamente en cuanto a estabilidad. [2] De manera similar, esta enzima actúa en una gran variedad de actividades biológicas, incluida la inducción de apoptosis , la inducción de edemas , la hemorragia y la inhibición o inducción de la agregación plaquetaria . [3]
Como lo sugiere el nombre de la familia, las LAAO son flavoenzimas que funcionan para catalizar la desaminación oxidativa estereoespecífica de un L- aminoácido . [4] Los tres sustratos de la reacción enzimática son un L- aminoácido , agua y oxígeno , mientras que los tres productos son el α- cetoácido correspondiente (2-oxoácido), amoníaco y peróxido de hidrógeno . Un ejemplo de la enzima en acción ocurre con la conversión de L-alanina en ácido pirúvico (ácido 2-oxopropanoico), como se muestra en la Figura 1.

Aunque las LAAO están presentes en una variedad de organismos eucariotas y procariotas, [5] el veneno de serpiente es una fuente particularmente rica de la enzima y se propone que las LAAO proporcionen efectos tóxicos en caso de envenenamiento. [3] [6] [7] Las LAAO que se han purificado a partir de los venenos de varias especies de serpientes han demostrado ser las más adecuadas para examinar esta nueva familia de enzimas. [8] Se ha determinado en la mayoría de los casos relacionados con las familias de serpientes, como Viperidae , Crotalidae y Elapidae , que el veneno de serpiente-LAAO (sv-LAAO) constituye aproximadamente el 1-9% de la cantidad total de proteína. [9]
La mayoría de los sv-LAAO se describen como homodímeros con múltiples subunidades que tienen pesos moleculares de alrededor de 50-70 kDa [6] y la interacción entre las subunidades ocurre a través de interacciones no covalentes . Los Sv-LAAO están presentes en las formas ácidas, básicas y neutras de la proteína. [6] Los estudios que analizan las estructuras cristalinas de rayos X han confirmado que los sv-LAAO a menudo se encuentran como dímeros funcionales, y cada dímero tiene tres dominios. Los tres dominios son el sitio de unión del sustrato , el sitio de unión de FAD y un dominio helicoidal. [8] Se determinó que el sitio de unión del sustrato de la enzima estaba en la base de un embudo largo que se extiende 25 Å desde la superficie hasta el interior de la proteína. [8] También se ha determinado que el grupo prostético FAD se arraiga profundamente en la estructura de la enzima, lo que permite interacciones generalizadas tanto con átomos vecinos como con moléculas de agua conservadas. [8] Además, este grupo prostético que contiene flavina ha sido clasificado como el que proporciona al veneno de serpiente su coloración amarilla oscura por excelencia, que se muestra en la Figura 2. [10]
Una característica inusual reportada para las sv-LAAO se refiere a las propiedades de inactivación por frío y reactivación por calor de la proteína. [11] Por lo tanto, la mayoría de las sv-LAAO se consideran enzimas termolábiles . [9]
Esta enzima pertenece a la familia de las oxidorreductasas , específicamente aquellas que actúan sobre el grupo de donadores CH-NH2 con oxígeno como aceptor. El nombre sistemático de esta clase de enzimas es L-aminoácido:oxigeno oxidorreductasa (desaminante) . Esta enzima también se denomina ofioaminoácido oxidasa . A finales de 2007, se han resuelto 11 estructuras para esta clase de enzimas, con los códigos de acceso PDB 1F8R, 1F8S, 1REO, 1TDK, 1TDN, 1TDO, 2IID, 2JAE, 2JB1, 2JB2 y 2JB3.
Se han explorado las actividades específicas de las sv-LAAO con varios L-aminoácidos. Muchos estudios muestran que varias sv-LAAO muestran una preferencia por los L-aminoácidos hidrófobos como sustratos. [12] Por ejemplo, los resultados han indicado que la mayoría de las sv-LAAO demuestran especificidades relativamente altas hacia aminoácidos hidrófobos como L- Met , L- Leu y L- Ile además de aminoácidos aromáticos como L- Phe y L- Trp . [8] [13]
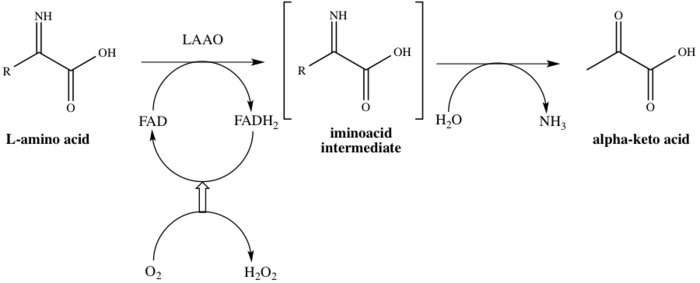
Esta enzima participa en 8 vías metabólicas : metabolismo de alanina y aspartato , metabolismo de metionina , degradación de valina , leucina e isoleucina , metabolismo de tirosina , metabolismo de fenilalanina , metabolismo de triptófano , biosíntesis de fenilalanina , tirosina y triptófano , y biosíntesis de alcaloides . Emplea un cofactor , el dinucleótido de flavina y adenina (FAD). La enzima se une al FAD en el primer paso del proceso catalítico, reduciendo así el FAD a FADH 2 . El FAD se regenera a partir de FADH 2 por oxidación como resultado de la reducción de O 2 a H 2 O 2 . El mecanismo procede a través de la desaminación oxidativa del L-aminoácido, que proporciona un intermedio de iminoácido . Después de la hidrólisis del intermedio, la enzima proporciona con éxito el 2-oxoácido, como se muestra en el Esquema 1. [8]
Se han descubierto diversas actividades biológicas a partir de sv-LAAO aislados, incluidas actividades citotóxicas , antibacterianas , antivirales y antiparasitarias , así como efectos de agregación plaquetaria . [14] Estas actividades se pueden definir por la capacidad de la enzima para provocar estrés oxidativo mediante la formación de radicales de oxígeno y peróxido de hidrógeno . [15] El mecanismo de acción particular de las sv-LAAO en términos de agregación plaquetaria se ha determinado con menos claridad, porque se sabe que algunas sv-LAAO crean agregados y algunas son factores antiagregantes. [16]
En estudios recientes, se ha demostrado que se han aislado LAAO de las secreciones mucosas de la piel y/o las branquias de peces roca, escorpión gigante y platija. [17] Se identificó que la presencia de estas enzimas es un tipo único de proteína antibacteriana en la defensa externa empleada por ciertas especies de peces.
Cabe destacar que, debido a su potencial como antimicrobiano , antitumoral y/o en el consumo de aminoácidos, el interés por la investigación de los sv-LAAO ha comenzado a crecer. [7] Muchos autores han investigado el mecanismo de acción antibacteriana de los sv-LAAO. Está bien establecido que los sv-LAAO matan y descomponen las bacterias por el H 2 O 2 que se produce como resultado de la reacción de oxidación que ocurre en el entorno circundante. [7]
En un estudio de caso, se informó que la sv-LAAO (aislada del veneno de C. durissus cascavella ) provocó la ruptura de las membranas bacterianas al tiempo que promovía la extravasación o fuga de contenido plasmático fuera de la estructura celular. Argumentaron que la cantidad de peróxido de hidrógeno generada era suficiente para inhibir el crecimiento bacteriano y que la capacidad de la enzima para unirse a las membranas bacterianas no es importante en su actividad antibacteriana. [18]
La enfermedad cardiovascular puede presentarse en muchas formas diferentes, desde miocardiopatía hasta enfermedad arterial periférica , y la enfermedad cardíaca sigue siendo una amenaza clave para la salud humana. Si bien existen medios de terapia para prevenir y curar enfermedades cardiovasculares , muchos medicamentos no están disponibles para uso clínico debido a los graves efectos secundarios además de los altos niveles de toxicidad. [9] Sin embargo, en la última década, los sv-LAAO han demostrado ser prometedores para afectar la agregación plaquetaria . Se ha propuesto que se considera que el peróxido de hidrógeno juega un papel importante con respecto a la capacidad de las enzimas para causar y prevenir esta agregación plaquetaria . [9] Con este conocimiento, parece que los sv-LAAO podrían evaluarse como un posible tratamiento terapéutico de la enfermedad cardiovascular debido a su potencia biológica.
Como consecuencia de las numerosas actividades en las que participa la enzima, se podría deducir que es probable que exista alguna función enzimática relacionada con la compleja red de actividades de la toxina del veneno. [4] Sin embargo, no se ha informado que el papel de las sv-LAAO en la patología inducida por veneno se haya evaluado de manera suficiente.
En virtud de sus propiedades antibacterianas, se ha especulado que las sv-LAAO son en parte responsables del mantenimiento y la estabilización tanto del veneno como de la glándula de veneno en las especies de serpientes. [4]