La síntesis de cetonas de Weinreb o síntesis de cetonas de Weinreb–Nahm es una reacción química utilizada en química orgánica para hacer enlaces carbono-carbono . Fue descubierta en 1981 por Steven M. Weinreb y Steven Nahm como un método para sintetizar cetonas . [1] La reacción original implicó dos sustituciones posteriores: la conversión de un cloruro de ácido con N , O -dimetilhidroxilamina , para formar una amida de Weinreb–Nahm , y el tratamiento posterior de esta especie con un reactivo organometálico como un reactivo de Grignard o un reactivo de organolitio . Nahm y Weinreb también informaron sobre la síntesis de aldehídos por reducción de la amida con un exceso de hidruro de litio y aluminio (ver reducción de amida ).

La principal ventaja de este método sobre la adición de reactivos organometálicos a compuestos acilo más típicos es que evita el problema común de la sobreadición. Para estas últimas reacciones, se suman dos equivalentes del grupo entrante para formar un alcohol en lugar de una cetona o un aldehído. Esto ocurre incluso si los equivalentes del nucleófilo están estrechamente controlados.

Desde entonces, los químicos orgánicos han adoptado la amida de Weinreb-Nahm como método de uso habitual para la síntesis de cetonas. Estos grupos funcionales están presentes en una gran cantidad de productos naturales y pueden reaccionar de manera confiable para formar nuevos enlaces carbono-carbono o convertirse en otros grupos funcionales. Este método se ha utilizado en varias síntesis, incluidas las de macrosphelides A y B, [2] anfidinolida J, [3] y espirofunginas A y B. [4]
Weinreb y Nahm propusieron originalmente el siguiente mecanismo de reacción para explicar la selectividad mostrada en las reacciones de la amida de Weinreb-Nahm. Su sugerencia fue que el intermediario tetraédrico ( A a continuación) formado como resultado de la adición nucleofílica por el reactivo organometálico se estabiliza por quelación del grupo metoxi como se muestra. [1] Este intermediario es estable solo a bajas temperaturas, lo que requiere un enfriamiento a baja temperatura .

Esta quelación contrasta con el mecanismo de formación del producto de sobreadición, en el que el colapso del intermediario tetraédrico permite una segunda adición. La conjetura mecanicista de Weinreb fue aceptada inmediatamente por la comunidad académica, pero no fue hasta 2006 que fue confirmada por análisis espectroscópicos y cinéticos. [5]
Además del procedimiento original que se muestra arriba (que puede tener problemas de compatibilidad con sustratos sensibles), las amidas de Weinreb se pueden sintetizar a partir de una variedad de compuestos de acilo . La gran mayoría de estos procedimientos utilizan la sal comercialmente disponible clorhidrato de N,O-dimetilhidroxilamina [MeO(Me)NH•HCl], que suele ser más fácil de manipular que la amina libre. [6]
El tratamiento de un éster o lactona con AlMe3 o AlMe2Cl produce la amida de Weinreb correspondiente con buenos rendimientos. Alternativamente, se pueden utilizar reactivos de Grignard no nucleofílicos, como el cloruro de isopropilmagnesio, para activar la amina antes de la adición del éster. [7]

También se pueden utilizar diversos reactivos de acoplamiento de péptidos para preparar amidas de Weinreb-Nahm a partir de ácidos carboxílicos. Se han descrito diversos acoplamientos basados en carbodiimida , hidroxibenzotriazol y trifenilfosfina específicamente para este propósito. [6] [7]

Finalmente, una reacción de aminocarbonilación informada por Stephen Buchwald permite la conversión de haluros de arilo directamente en amidas de arilo de Weinreb-Nahm. [8]

Se sabe que las condiciones estándar para la síntesis de cetonas de Weinreb-Nahm toleran una amplia variedad de grupos funcionales en otras partes de la molécula, incluyendo la sustitución alfa-halógena, aminoácidos N-protegidos , insaturación α-β, éteres de sililo , varias lactamas y lactonas, sulfonatos , sulfinatos y ésteres de fosfonato. [6] [7] Se puede utilizar una amplia variedad de nucleófilos junto con la amida. Los litiatos y reactivos de Grignard son los más comúnmente empleados; se han reportado ejemplos que involucran nucleófilos de carbono alifático , vinílico , arílico y alquinílico . Sin embargo, con nucleófilos altamente básicos o estéricamente impedidos, la eliminación de la fracción metóxido para liberar formaldehído puede ocurrir como una reacción secundaria significativa. [9]

No obstante, la amida de Weinreb-Nahm ocupa un lugar destacado en muchas síntesis, ya que actúa como un importante socio de acoplamiento para varios fragmentos. A continuación se muestran los pasos clave que involucran a las amidas de Weinreb en la síntesis de varios productos naturales, incluidos miembros de la familia de inmunosupresores de los macrosphélides y la familia de antibióticos de las espirofunginas. [2] [3] [4]

Se ha llevado a cabo la reacción de amidas de Weinreb-Nahm con reactivos de Wittig para evitar las condiciones a veces duras que se requieren para la adición de reactivos de hidruro o compuestos organometálicos. Esto produce una N-metil-N-metoxi- enamina que se convierte en la cetona o aldehído correspondiente tras el tratamiento hidrolítico. [10]

Además, se ha desarrollado un intercambio de magnesio-halógeno en un solo recipiente con arilación posterior, lo que demuestra la estabilidad de la amida de Weinreb-Nahm y proporciona un método operativamente simple para la síntesis de arilcetonas. [11]
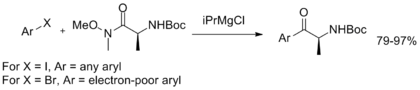
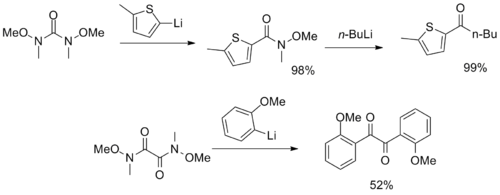
Se han sintetizado reactivos más inusuales con múltiples grupos funcionales de amida de Weinreb-Nahm, que sirven como sintones de CO2 y α-dicetona . [12] [13]
Finalmente, Stephen G. Davies de Oxford ha diseñado un auxiliar quiral que combina la funcionalidad de la amida de Weinreb con la del auxiliar pseudoefedrina de Myers , permitiendo la alquilación diastereoselectiva del enolato seguida de una fácil escisión al aldehído o cetona enantioenriquecido correspondiente. [14]
