La relación aire-combustible ( AFR ) es la relación másica entre aire y combustible sólido, líquido o gaseoso presente en un proceso de combustión . La combustión puede tener lugar de forma controlada, como en un motor de combustión interna o en un horno industrial, o puede dar lugar a una explosión (por ejemplo, una explosión de polvo , una explosión de gas o vapor o en un arma termobárica ).
La relación aire-combustible determina si una mezcla es combustible, cuánta energía se libera y cuántos contaminantes no deseados se producen en la reacción. Normalmente existe un rango de proporciones de combustible a aire, fuera del cual no se producirá la ignición. Estos se conocen como límites explosivos inferior y superior.
En un motor de combustión interna o en un horno industrial, la relación aire-combustible es una medida importante por motivos de lucha contra la contaminación y de ajuste del rendimiento. Si se proporciona exactamente suficiente aire para quemar completamente todo el combustible, la proporción se conoce como mezcla estequiométrica , a menudo abreviada como estoico . Las proporciones inferiores a las estequiométricas (donde hay exceso de combustible) se consideran "ricas". Las mezclas ricas son menos eficientes, pero pueden producir más energía y quemarse a menor temperatura. Las proporciones superiores a las estequiométricas (donde hay exceso de aire) se consideran "pobres". Las mezclas pobres son más eficientes pero pueden causar temperaturas más altas, lo que puede conducir a la formación de óxidos de nitrógeno . Algunos motores están diseñados con características que permiten la combustión pobre . Para realizar cálculos precisos de la relación aire-combustible, se debe especificar el contenido de oxígeno del aire de combustión debido a la diferente densidad del aire debido a la diferente altitud o temperatura del aire de admisión, posible dilución por vapor de agua ambiental o enriquecimiento por adiciones de oxígeno.
En teoría, una mezcla estequiométrica tiene suficiente aire para quemar completamente el combustible disponible. En la práctica, esto nunca se logra del todo, debido principalmente al muy poco tiempo disponible en un motor de combustión interna para cada ciclo de combustión.
La mayor parte del proceso de combustión se completa en aproximadamente 2 milisegundos a una velocidad del motor de6.000 revoluciones por minuto . (100 revoluciones por segundo; 10 milisegundos por revolución del cigüeñal. Para un motor de cuatro tiempos significaría 5 milisegundos por cada carrera del pistón y 20 milisegundos para completar un ciclo de cuatro tiempos y 720 grados (el ciclo Otto). Este es el tiempo que transcurre desde que se enciende la bujía hasta que se quema el 90% de la mezcla de combustible y aire, generalmente unos 80 grados de rotación del cigüeñal después. Los convertidores catalíticos están diseñados para funcionar mejor cuando los gases de escape que pasan a través de ellos son el resultado de una combustión casi perfecta. .
Una mezcla perfectamente estequiométrica arde muy caliente y puede dañar los componentes del motor si el motor se somete a una carga elevada con esta mezcla de aire y combustible. Debido a las altas temperaturas en esta mezcla, la detonación de la mezcla de combustible y aire mientras se acerca o poco después de la presión máxima del cilindro es posible bajo carga alta (lo que se conoce como golpes o ping), específicamente un evento de "predetonación" en el contexto. de un modelo de motor de encendido por chispa. Esta detonación puede causar daños graves al motor, ya que la quema incontrolada de la mezcla de aire y combustible puede crear presiones muy altas en el cilindro. Como consecuencia, las mezclas estequiométricas sólo se utilizan en condiciones de carga ligeras a moderadas. Para condiciones de aceleración y carga alta, se utiliza una mezcla más rica (menor relación aire-combustible) para producir productos de combustión más fríos (utilizando así enfriamiento por evaporación ) y así evitar el sobrecalentamiento de la culata del cilindro y así prevenir la detonación.
La mezcla estequiométrica para un motor de gasolina es la proporción ideal de aire y combustible que quema todo el combustible sin exceso de aire. Para el combustible de gasolina , la mezcla estequiométrica de aire y combustible es de aproximadamente 14,7:1 [1] , es decir, por cada gramo de combustible, se requieren 14,7 gramos de aire. Para combustible de octanaje puro , la reacción de oxidación es:
Cualquier mezcla superior a 14,7:1 se considera mezcla pobre ; cualquier proporción inferior a 14,7:1 es una mezcla rica , dado el combustible de "prueba" perfecto (ideal) (gasolina que consiste únicamente en n - heptano e isooctano ). En realidad, la mayoría de los combustibles consisten en una combinación de heptano, octano y un puñado de otros alcanos , además de aditivos que incluyen detergentes y posiblemente oxigenadores como MTBE ( metil terc -butil éter ) o etanol / metanol . Todos estos compuestos alteran la relación estequiométrica, y la mayoría de los aditivos empujan la relación hacia abajo (los oxigenadores aportan oxígeno adicional al evento de combustión en forma líquida que se libera en el momento de la combustión; para el combustible cargado de MTBE , una relación estequiométrica puede ser tan tan bajo como 14,1:1). Los vehículos que utilizan un sensor de oxígeno u otros circuitos de retroalimentación para controlar la relación combustible-aire (control lambda), compensan automáticamente este cambio en la tasa estequiométrica del combustible midiendo la composición de los gases de escape y controlando el volumen de combustible. Los vehículos sin tales controles (como la mayoría de las motocicletas hasta hace poco y los automóviles anteriores a mediados de la década de 1980) pueden tener dificultades para ejecutar ciertas mezclas de combustible (especialmente los combustibles de invierno utilizados en algunas áreas) y pueden requerir diferentes surtidores de carburador (o tener alteradas las proporciones de combustible). ) para compensar. Los vehículos que utilizan sensores de oxígeno pueden controlar la relación aire-combustible con un medidor de relación aire-combustible .
En el típico quemador de combustión de aire a gas natural, se emplea una estrategia de límite de doble cruce para asegurar el control de la relación. (Este método se utilizó en la Segunda Guerra Mundial). [ cita necesaria ] La estrategia implica agregar la retroalimentación de flujo opuesta al control limitante del gas respectivo (aire o combustible). Esto asegura el control de la proporción dentro de un margen aceptable.
Hay otros términos comúnmente utilizados cuando se habla de la mezcla de aire y combustible en los motores de combustión interna.
Mezcla es la palabra predominante que aparece en los textos de formación, manuales de operación y manuales de mantenimiento en el mundo de la aviación.
La relación aire-combustible es la relación entre la masa de aire y la masa de combustible en la mezcla combustible-aire en un momento dado. La masa es la masa de todos los constituyentes que componen el combustible y el aire, sean combustibles o no. Por ejemplo, un cálculo de la masa de gas natural, que a menudo contiene dióxido de carbono ( CO
2), nitrógeno ( norte
2), y varios alcanos : incluye la masa del dióxido de carbono, el nitrógeno y todos los alcanos para determinar el valor de m combustible . [2]
Para el octanaje puro , la mezcla estequiométrica es aproximadamente 15,1:1, o λ de 1,00 exactamente.
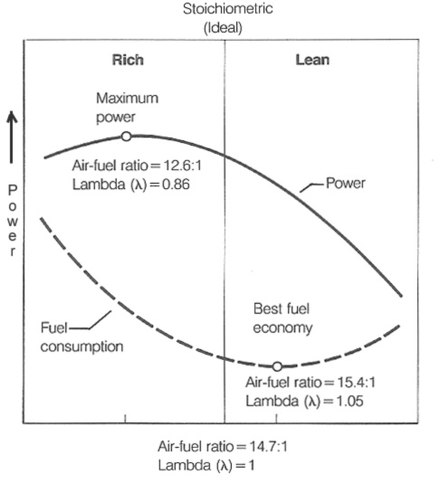
En los motores atmosféricos propulsados por octanaje, la potencia máxima se alcanza frecuentemente con AFR que oscilan entre 12,5 y 13,3:1 o λ de 0,850 a 0,901. [ cita necesaria ]
La relación aire-combustible de 12:1 se considera la relación de salida máxima, mientras que la relación aire-combustible de 16:1 se considera la relación máxima de economía de combustible. [ cita necesaria ]
La relación combustible-aire se utiliza comúnmente en la industria de las turbinas de gas , así como en estudios gubernamentales sobre motores de combustión interna , y se refiere a la relación entre combustible y aire. [ cita necesaria ]
La relación de equivalencia aire-combustible, λ (lambda), es la relación entre la AFR real y la estequiometría para una mezcla determinada. λ = 1,0 es en estequiometría, mezclas ricas λ < 1,0 y mezclas pobres λ > 1,0.
Existe una relación directa entre λ y AFR. Para calcular el AFR a partir de un λ determinado, multiplique el λ medido por el AFR estequiométrico para ese combustible. Alternativamente, para recuperar λ de un AFR, divida el AFR por el AFR estequiométrico de ese combustible. Esta última ecuación se utiliza a menudo como definición de λ :
Debido a que la composición de los combustibles comunes varía según las estaciones, y debido a que muchos vehículos modernos pueden manejar diferentes combustibles cuando se ajustan, tiene más sentido hablar de valores λ en lugar de AFR.
La mayoría de los dispositivos AFR prácticos en realidad miden la cantidad de oxígeno residual (para mezclas pobres) o hidrocarburos no quemados (para mezclas ricas) en los gases de escape.
La relación de equivalencia combustible-aire , ϕ (phi), de un sistema se define como la relación entre la relación combustible-oxidante y la relación estequiométrica combustible-oxidante. Matemáticamente,
donde m representa la masa, n representa una cantidad de moles, el subíndice st representa condiciones estequiométricas.
La ventaja de utilizar la relación de equivalencia sobre la relación combustible-oxidante es que tiene en cuenta (y por lo tanto es independiente de) los valores de masa y molares del combustible y del oxidante. Considere, por ejemplo, una mezcla de un mol de etano ( C
2h
6) y un mol de oxígeno ( O
2). La relación combustible-oxidante de esta mezcla basada en la masa de combustible y aire es
y la relación combustible-oxidante de esta mezcla basada en el número de moles de combustible y aire es
Es evidente que los dos valores no son iguales. Para compararlo con la relación de equivalencia, necesitamos determinar la relación combustible-oxidante de la mezcla de etano y oxígeno. Para ello debemos considerar la reacción estequiométrica del etano y el oxígeno,
Esto da
Por tanto, podemos determinar la relación de equivalencia de la mezcla dada como
o, equivalentemente, como
Otra ventaja de utilizar la relación de equivalencia es que relaciones mayores que uno siempre significan que hay más combustible en la mezcla combustible-oxidante del requerido para una combustión completa (reacción estequiométrica), independientemente del combustible y el oxidante que se utilicen, mientras que relaciones menores que uno representan una deficiencia de combustible o equivalentemente un exceso de oxidante en la mezcla. Este no es el caso si se utiliza la relación combustible-oxidante, que toma valores diferentes para diferentes mezclas.
La relación de equivalencia aire-combustible está relacionada con la relación de equivalencia aire-combustible (definida anteriormente) de la siguiente manera:
Las cantidades relativas de enriquecimiento de oxígeno y dilución de combustible se pueden cuantificar mediante la fracción de mezcla , Z, definida como
dónde
Y F,0 y Y O,0 representan las fracciones de masa de combustible y oxidante en la entrada, W F y W O son los pesos moleculares de las especies, y v F y v O son los coeficientes estequiométricos de combustible y oxígeno, respectivamente. La fracción estequiométrica de la mezcla es
La fracción estequiométrica de la mezcla está relacionada con λ (lambda) y ϕ (phi) mediante las ecuaciones
asumiendo
En calentadores industriales , generadores de vapor de centrales eléctricas y grandes turbinas alimentadas por gas , los términos más comunes son porcentaje de exceso de aire de combustión y porcentaje de aire estequiométrico. [5] [6] Por ejemplo, un exceso de aire de combustión del 15 por ciento significa que se está utilizando un 15 por ciento más que el aire estequiométrico requerido (o 115 por ciento de aire estequiométrico).
Un punto de control de combustión se puede definir especificando el porcentaje de exceso de aire (u oxígeno) en el oxidante , o especificando el porcentaje de oxígeno en el producto de la combustión. [7] Se puede utilizar un medidor de relación aire-combustible para medir el porcentaje de oxígeno en el gas de combustión, a partir del cual se puede calcular el porcentaje de exceso de oxígeno a partir de la estequiometría y un balance de masa para la combustión de combustible. Por ejemplo, para propano ( C
3h
8) combustión entre estequiométrico y 30 por ciento de exceso de aire ( masa AFR entre 15,58 y 20,3), la relación entre el porcentaje de exceso de aire y el porcentaje de oxígeno es: