En química orgánica , la adición de aldol de Mukaiyama es una reacción orgánica y un tipo de reacción aldólica entre un silil enol éter ( R 2 C = CR − O − Si (CH 3 ) 3 ) y un aldehído ( R − CH = O ) o formiato ( R − O − CH = O ). [1] La reacción fue descubierta por Teruaki Mukaiyama en 1973. [2] Su elección de reactivos permite una reacción aldólica cruzada entre un aldehído y una cetona ( >C=O ), o un aldehído diferente sin autocondensación del aldehído. . Por esta razón, la reacción se utiliza ampliamente en síntesis orgánica .
La adición de aldol de Mukaiyama es una adición mediada por ácido de Lewis de enol silanos a compuestos carbonílicos ( C=O ). En esta reacción se pueden utilizar compuestos con diversos grupos orgánicos (ver eductos). [3] A continuación se muestra una versión básica ( R 2 = H) sin la presencia de catalizadores quirales .

Se construye una mezcla racémica de enantiómeros . Si en esta reacción se utilizan silanos Z- o E-enol, se produce una mezcla de cuatro productos, dando dos racematos.

La construcción del antidiastereómero o del sindiastereómero depende en gran medida de las condiciones de reacción, los sustratos y los ácidos de Lewis.
La reacción arquetípica es la del silil enol éter de ciclohexanona , (CH 2 ) 5 CO , con benzaldehído , C 6 H 5 CHO . A temperatura ambiente produce una mezcla diastereoisómera de treo (63%) y eritro (19%) β- hidroxicetona , así como un 6% del producto de condensación de enona exocíclico . En su ámbito original, el ácido de Lewis ( tetracloruro de titanio , TiCl 4 ) se utilizaba en cantidades estequiométricas, pero también existen sistemas verdaderamente catalíticos. La reacción también está optimizada para síntesis asimétrica .
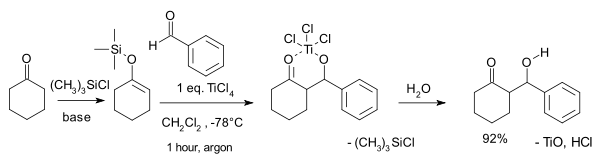
A continuación, se muestra el mecanismo de reacción con R 2 = H:
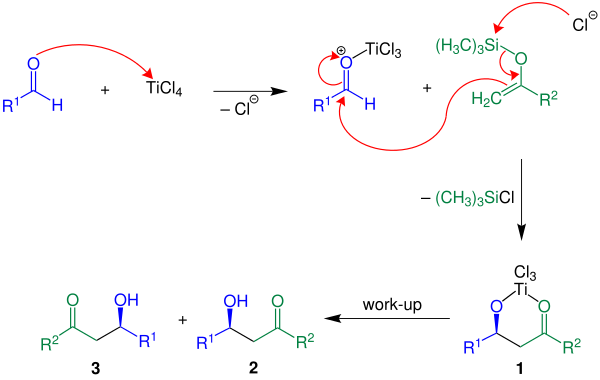
En el ejemplo citado se utiliza el ácido de Lewis TiCl 4 . Primero, el ácido de Lewis activa el componente aldehído seguido de la formación de un enlace carbono-carbono entre el enol silano y el aldehído activado. Con la pérdida de un clorosilano se forma el compuesto 1 . El producto deseado, un racemato de 2 y 3 , se obtiene mediante tratamiento acuoso. [3]
La reacción aldólica de Mukaiyama no sigue el modelo de Zimmerman-Traxler. Carreira ha descrito una metodología asimétrica particularmente útil con acetales de silil ceteno, destacable por sus altos niveles de enantioselectividad y amplio alcance de sustrato. [4] El método funciona con aldehídos alifáticos no ramificados , que a menudo son electrófilos pobres para procesos catalíticos y asimétricos. Esto puede deberse a una pobre diferenciación electrónica y estérica entre sus enantiocaras .
El proceso aldólico análogo de Mukaiyama también puede volverse catalítico y asimétrico. El ejemplo que se muestra a continuación funciona eficientemente para aldehídos aromáticos (pero no alifáticos) y se cree que el mecanismo implica un dienolato quiral unido a un metal. [5] [6]
Una reacción típica que involucra dos cetonas es la que ocurre entre la acetofenona como enol y la acetona : [7]

Las reacciones cetonas de este tipo requieren temperaturas de reacción más altas. Para este trabajo, Mukaiyama se inspiró en un trabajo anterior realizado por Georg Wittig en 1966 sobre reacciones aldólicas cruzadas con iminas litiadas . [8] [9] Herbert O. House publicó también en 1973 un trabajo competitivo con reacciones aldólicas de enolato de litio. [10]
Mukaiyama empleó en su interpretación de la síntesis total de taxol (1999) dos adiciones de aldol, [11] [12] una con un ceteno silil acetal y un exceso de bromuro de magnesio :

y un segundo con un ligando quiral de amina y un catalizador de sal triflato :

La utilización de complejos quirales de ácidos de Lewis y bases de Lewis en procesos catalíticos asimétricos es el área de más rápido crecimiento en el uso de la reacción aldólica de Mukaiyama. [3]