La tripanosomiasis africana es una infección parasitaria transmitida por insectos que afecta a los seres humanos y otros animales. [3]
La tripanosomiasis africana humana (TAH), también conocida como enfermedad del sueño africana o simplemente enfermedad del sueño , es causada por la especie Trypanosoma brucei . [3] Los humanos se infectan por dos tipos, Trypanosoma brucei gambiense (TbG) y Trypanosoma brucei rhodesiense (TbR). [3] La TbG causa más del 92% de los casos notificados. [1] Ambas suelen transmitirse por la picadura de una mosca tsé-tsé infectada y son más comunes en las zonas rurales. [3]
Inicialmente, la primera etapa de la enfermedad se caracteriza por fiebre, dolores de cabeza, picazón y dolores articulares, que comienzan una a tres semanas después de la picadura. [1] [2] Semanas o meses después, comienza la segunda etapa con confusión, falta de coordinación, entumecimiento y dificultad para dormir. [2] El diagnóstico se realiza mediante la búsqueda del parásito en un frotis de sangre o en el líquido de un ganglio linfático. [2] A menudo se necesita una punción lumbar para diferenciar entre la enfermedad de primera y segunda etapa. [2] Si la enfermedad no se trata rápidamente, puede provocar la muerte.
La prevención de la enfermedad grave implica la detección de la TbG en la población de riesgo mediante análisis de sangre. [3] El tratamiento es más fácil cuando la enfermedad se detecta de forma temprana y antes de que aparezcan los síntomas neurológicos. [3] El tratamiento de la primera etapa se ha realizado con los medicamentos pentamidina o suramina . [3] El tratamiento de la segunda etapa ha implicado eflornitina o una combinación de nifurtimox y eflornitina para la TbG. [2] [3] El fexinidazol es un tratamiento más reciente que se puede tomar por vía oral, para cualquiera de las etapas de la TbG. [3] Aunque el melarsoprol funciona para ambos tipos, normalmente solo se utiliza para la TbR, debido a los graves efectos secundarios. [3] Sin tratamiento, la enfermedad del sueño suele provocar la muerte. [3]
La enfermedad se presenta regularmente en algunas regiones del África subsahariana y la población en riesgo es de unos 70 millones en 36 países. [5] Se estima que 11.000 personas están infectadas actualmente con 2.800 nuevas infecciones en 2015. [6] [1] En 2018 hubo 977 casos nuevos. [3] En 2015 causó alrededor de 3.500 muertes, por debajo de las 34.000 en 1990. [4] [7] Más del 80% de estos casos se encuentran en la República Democrática del Congo . [1] Se han producido tres brotes importantes en la historia reciente: uno de 1896 a 1906 principalmente en Uganda y la cuenca del Congo , y dos en 1920 y 1970, en varios países africanos. [1] Está clasificada como una enfermedad tropical desatendida . [8] Otros animales, como las vacas, pueden ser portadores de la enfermedad e infectarse, en cuyo caso se conoce como Nagana o tripanosomiasis animal . [1]
Los síntomas de la tripanosomiasis africana se presentan en dos etapas: la etapa hemolinfática y la etapa neurológica (esta última se caracteriza por la invasión parasitaria del sistema nervioso central). [9] [10] Los síntomas neurológicos se presentan además de las características iniciales, y las dos etapas pueden ser difíciles de distinguir basándose únicamente en las características clínicas. [10]
Se ha informado que la enfermedad se presenta con síntomas atípicos en individuos infectados que provienen de áreas no endémicas (por ejemplo, viajeros). Las razones para esto no están claras y pueden ser genéticas. El bajo número de tales casos también puede haber sesgado los hallazgos. En tales personas, se dice que la infección se presenta principalmente como fiebre con síntomas gastrointestinales (por ejemplo, diarrea e ictericia) y rara vez se desarrolla linfadenopatía . [11]
La enfermedad sistémica a veces se predice mediante una úlcera tripanosómica que se desarrolla en el lugar de la picadura de la mosca infecciosa dentro de los dos días posteriores a la infección. La úlcera se observa con mayor frecuencia en la infección por T. b. rhodesiense y solo raramente en la infección por T. b. gambiense (sin embargo, en la infección por T. b. gambiense , las úlceras son más comunes en personas de áreas no endémicas). [10]
El período de incubación es de 1 a 3 semanas para T. b. rhodesiense, y más largo (pero menos caracterizado con precisión) en la infección por T. b. gambiense . La primera etapa/etapa inicial, conocida como fase hemolinfática, se caracteriza por síntomas generalizados no específicos [10] como: fiebre (intermitente) , dolores de cabeza (severos), [12] dolores articulares , picazón , [9] [10] debilidad, malestar, fatiga, pérdida de peso, linfadenopatía y hepatoesplenomegalia . [10]
El diagnóstico puede retrasarse debido a la imprecisión de los síntomas iniciales. La enfermedad también puede confundirse con la malaria (que, de hecho, puede presentarse como una coinfección). [11]
La fiebre es intermitente, con ataques que duran de un día a una semana, separados por intervalos de unos pocos días a un mes o más. [9] [10] Los episodios de fiebre se vuelven menos frecuentes a lo largo de la enfermedad. [10]
La invasión de los sistemas circulatorio y linfático por el parásito se asocia con una inflamación grave de los ganglios linfáticos , a menudo de enormes tamaños. [9] Los ganglios linfáticos cervicales posteriores son los más comúnmente afectados, sin embargo, también puede ocurrir afectación de los ganglios linfáticos axilares, inguinales y epitrocleares. [10] Puede aparecer el signo de Winterbottom , los ganglios linfáticos inflamados característicos a lo largo de la parte posterior del cuello. [9] El signo de Winterbottom es común en la infección por T. b. gambiense . [10]
Los afectados pueden presentar además: erupción cutánea, [12] anemia hemolítica, hepatomegalia y función hepática anormal, esplenomegalia, alteraciones endocrinas, afectación cardíaca (por ejemplo, pericarditis e insuficiencia cardíaca congestiva) y afectación oftálmica. [11]
La segunda fase de la enfermedad, la fase neurológica (también llamada etapa meningoencefálica [10] ), comienza cuando el parásito invade el sistema nervioso central atravesando la barrera hematoencefálica . [9] La progresión a la fase neurológica ocurre después de aproximadamente 21 a 60 días en el caso de la infección por T. b. rhodesiens e, y de 300 a 500 días en el caso de la infección por T. b. gambiense . [10]
En realidad, las dos fases se superponen y son difíciles de distinguir basándose únicamente en las características clínicas; para determinar la etapa real de la enfermedad se examina el líquido cefalorraquídeo para detectar la presencia del parásito. [10]
Los trastornos del sueño y la vigilia son una característica principal de la etapa neurológica [9] [15] y dan a la enfermedad su nombre común de "enfermedad del sueño". [9] [10] [15] Las personas infectadas experimentan un ciclo de sueño y vigilia desorganizado y fragmentado. [9] Los afectados experimentan una inversión del sueño que resulta en sueño diurno [9] y somnolencia, [10] y períodos nocturnos de vigilia [9] e insomnio. [10] Además, los afectados también experimentan episodios de somnolencia repentina. [10]
Los síntomas neurológicos incluyen: temblor , debilidad muscular general, hemiparesia , parálisis de una extremidad, [16] tono muscular anormal, alteración de la marcha, ataxia, alteraciones del habla, parestesia, hiperestesia, anestesia, alteración visual, reflejos anormales, convulsiones y coma. [10] Los movimientos similares a los del Parkinson pueden surgir debido a trastornos del movimiento no específicos y trastornos del habla. [16]
Los individuos pueden presentar síntomas psiquiátricos que a veces pueden dominar el diagnóstico clínico y pueden incluir agresividad, apatía , [10] [16] irritabilidad, reacciones psicóticas [16] y alucinaciones , ansiedad , labilidad emocional , confusión , manía , déficit de atención y delirio . [10]
Sin tratamiento, la enfermedad es invariablemente mortal, con un deterioro mental progresivo que lleva al coma, insuficiencia orgánica sistémica y muerte. Una infección no tratada con T. b. rhodesiense causará la muerte en cuestión de meses [17], mientras que una infección no tratada con T. b. gambiense causará la muerte después de varios años [18] . Los daños causados en la fase neurológica son irreversibles [19] .
Trypanosoma brucei gambiense es responsable de la mayoría de los casos de tripanosomiasis africana, siendo los humanos el principal reservorio necesario para la transmisión, mientras que Trypanosoma brucei rhodesiense es principalmente zoonótico, con infecciones humanas accidentales. [20] La epidemiología de la tripanosomiasis africana depende de las interacciones entre el parásito (tripanosoma), el vector ( mosca tsé-tsé ) y el huésped. [20]
Existen dos subespecies del parásito que son responsables de iniciar la enfermedad en los seres humanos. Trypanosoma brucei gambiense causa las enfermedades en África occidental y central , mientras que Trypanosoma brucei rhodesiense tiene un rango geográfico limitado y es responsable de causar la enfermedad en África oriental y meridional. Además, una tercera subespecie del parásito conocida como Trypanosoma brucei brucei es responsable de afectar a los animales pero no a los seres humanos. [16]
Los seres humanos son el principal reservorio de T. b. gambiense , pero esta especie también se puede encontrar en cerdos y otros animales. Los animales de caza y el ganado son el principal reservorio de T. b. rhodesiense . Estos parásitos infectan principalmente a individuos en el África subsahariana porque es allí donde se encuentra el vector (la mosca tsé-tsé). Las dos formas humanas de la enfermedad también varían mucho en intensidad. T. b. gambiense causa una afección crónica que puede permanecer en una fase pasiva durante meses o años antes de que aparezcan los síntomas y la infección puede durar unos tres años antes de que se produzca la muerte. [16]
T. b. rhodesiense es la forma aguda de la enfermedad y la muerte puede ocurrir en cuestión de meses, ya que los síntomas aparecen en semanas, y es más virulenta y se desarrolla más rápido que T. b. gambiense . Además, los tripanosomas están rodeados por una capa que se compone de glucoproteínas de superficie variantes (VSG). Estas proteínas actúan para proteger al parásito de cualquier factor lítico presente en el plasma humano. El sistema inmunológico del huésped reconoce las glucoproteínas presentes en la capa del parásito, lo que lleva a la producción de diferentes anticuerpos (IgM e IgG). [16]
Estos anticuerpos actuarán entonces para destruir los parásitos que circulan por la sangre. Sin embargo, de los varios parásitos presentes en el plasma, un pequeño número de ellos experimentará cambios en sus capas superficiales que resultarán en la formación de nuevos VSG. Por lo tanto, los anticuerpos producidos por el sistema inmunológico ya no reconocerán al parásito, lo que conducirá a la proliferación hasta que se creen nuevos anticuerpos para combatir los nuevos VSG. Finalmente, el sistema inmunológico ya no podrá luchar contra el parásito debido a los cambios constantes en los VSG y surgirá la infección. [16]

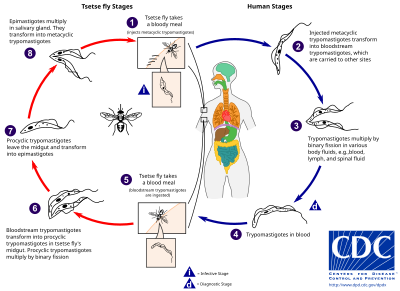
La mosca tsé-tsé (género Glossina ) es una mosca grande, marrón y picadora que sirve como hospedador y vector para los parásitos tripanosomas . Al extraer sangre de un hospedador mamífero, una mosca tsé-tsé infectada inyecta tripomastigotes metacíclicos en el tejido cutáneo. A partir de la picadura, los parásitos ingresan primero al sistema linfático y luego pasan al torrente sanguíneo. Dentro del hospedador mamífero, se transforman en tripomastigotes del torrente sanguíneo y son transportados a otros sitios en todo el cuerpo, alcanzan otros fluidos corporales (por ejemplo, linfa, líquido cefalorraquídeo) y continúan replicándose por fisión binaria . [21] [22]
El ciclo de vida completo de los tripanosomas africanos está representado por etapas extracelulares. Una mosca tsé-tsé se infecta con tripomastigotes del torrente sanguíneo cuando se alimenta de sangre de un huésped mamífero infectado. En el intestino medio de la mosca, los parásitos se transforman en tripomastigotes procíclicos, se multiplican por fisión binaria, abandonan el intestino medio y se transforman en epimastigotes. Los epimastigotes llegan a las glándulas salivales de la mosca y continúan multiplicándose por fisión binaria. [23]
El ciclo de vida completo de la mosca dura aproximadamente tres semanas. Además de la picadura de la mosca tsé-tsé , la enfermedad puede transmitirse por:
Los tábanos ( Tabanidae ) y las moscas de los establos ( Muscidae ) posiblemente desempeñen un papel en la transmisión de la nagana (la forma animal de la enfermedad del sueño) y la forma humana de la enfermedad. [26]
El triptofol es un compuesto químico producido por el parásito tripanosomal de la enfermedad del sueño, que induce el sueño en los humanos. [27]

El método de referencia para el diagnóstico es la identificación de tripanosomas en una muestra mediante examen microscópico. Las muestras que se pueden utilizar para el diagnóstico incluyen líquido de úlcera , aspirados de ganglios linfáticos, sangre, médula ósea y, durante la etapa neurológica, líquido cefalorraquídeo . La detección de anticuerpos específicos contra tripanosomas se puede utilizar para el diagnóstico, pero la sensibilidad y especificidad de estos métodos son demasiado variables para ser utilizados por sí solos para el diagnóstico clínico. Además, la seroconversión ocurre después del inicio de los síntomas clínicos durante una infección por T. b. rhodesiense , por lo que su utilidad diagnóstica es limitada. [ cita requerida ]
Los tripanosomas se pueden detectar en muestras utilizando dos preparaciones diferentes. Se puede utilizar una preparación húmeda para buscar los tripanosomas móviles. Alternativamente, se puede teñir un frotis fijo (seco) utilizando la técnica de Giemsa o Field y examinarlo bajo un microscopio. A menudo, el parásito se encuentra en una abundancia relativamente baja en la muestra, por lo que se pueden utilizar técnicas para concentrar los parásitos antes del examen microscópico. Para las muestras de sangre, estas incluyen la centrifugación seguida del examen de la capa leucocítica ; el miniintercambio aniónico/centrifugación; y la técnica de capa leucocítica cuantitativa (QBC). Para otras muestras, como el líquido cefalorraquídeo, las técnicas de concentración incluyen la centrifugación seguida del examen del sedimento. [ cita requerida ]
También existen tres pruebas serológicas para la detección del parásito: la micro-CATT (prueba de aglutinación en tarjeta para la tripanosomiasis), wb-CATT y wb-LATEX. La primera utiliza sangre seca, mientras que las otras dos utilizan muestras de sangre completa. Un estudio de 2002 determinó que la wb-CATT era la más eficiente para el diagnóstico, mientras que la wb-LATEX es un examen mejor para situaciones en las que se requiere una mayor sensibilidad. [28]

Actualmente, existen pocas opciones de prevención médicas para la tripanosomiasis africana (es decir, no existe una vacuna que proporcione inmunidad). Aunque el riesgo de infección por una picadura de mosca tsé-tsé es mínimo (se estima que es inferior al 0,1 %), el uso de repelentes de insectos, el uso de ropa de manga larga, evitar las zonas con mayor densidad de moscas tsé-tsé, la aplicación de métodos de desbroce de arbustos y la matanza selectiva de animales salvajes son las mejores opciones disponibles para evitar la infección para los residentes locales de las zonas afectadas. [16]
En julio de 2000 se aprobó una resolución para formar la Campaña Panafricana de Erradicación de la Mosca Tsetsé y la Tripanosomiasis (PATTEC). La campaña tiene por objeto erradicar los niveles de población del vector tsé-tsé y, posteriormente, la enfermedad protozoaria, mediante el uso de dianas impregnadas con insecticidas, trampas para moscas, ganado tratado con insecticidas, pulverizaciones aéreas y terrestres de dosis ultra bajas de los lugares de descanso de las moscas tsé-tsé y la técnica de los insectos estériles (SIT). [30] El uso de la SIT en Zanzíbar resultó eficaz para eliminar toda la población de moscas tsé-tsé, pero fue costoso y su uso es relativamente poco práctico en muchos de los países endémicos afectados por la tripanosomiasis africana. [31]
Un programa piloto en Senegal ha reducido la población de moscas tsé-tsé hasta en un 99% introduciendo moscas macho esterilizadas mediante exposición a rayos gamma . [32] [33]
La vigilancia activa regular, que incluye la detección y el tratamiento inmediato de nuevas infecciones, y el control de la mosca tsé-tsé es la columna vertebral de la estrategia utilizada para controlar la enfermedad del sueño. El cribado sistemático de las comunidades en riesgo es el mejor enfoque, porque el cribado caso por caso no es práctico en las regiones endémicas. El cribado sistemático puede realizarse en forma de clínicas móviles o centros de cribado fijos donde los equipos viajan diariamente a zonas con altas tasas de infección. Estas actividades de cribado son importantes porque los síntomas iniciales no son evidentes ni lo suficientemente graves como para justificar que las personas con enfermedad gambiense busquen atención médica, en particular en zonas muy remotas. Además, el diagnóstico de la enfermedad es difícil y los trabajadores de la salud pueden no asociar esos síntomas generales con la tripanosomiasis. El cribado sistemático permite detectar la enfermedad en su fase inicial y tratarla antes de que progrese, y elimina el posible reservorio humano. [34] Se ha notificado un solo caso de transmisión sexual de la enfermedad del sueño de África occidental. [25]
El tratamiento depende de si la enfermedad se detecta en la primera o segunda etapa de la enfermedad. Un requisito para el tratamiento de la segunda etapa es que el fármaco atraviese la barrera hematoencefálica .
El tratamiento para la enfermedad en etapa inicial es fexinidazol por vía oral o pentamidina por inyección para T. b. gambiense . [3] La suramina por inyección se utiliza para T. b. rhodesiense . [3]
El fexinidazol puede utilizarse para la segunda etapa de TbG, si la enfermedad no es grave. [35] [3] De lo contrario, un régimen que incluya la combinación de nifurtimox y eflornitina , el tratamiento combinado de nifurtimox-eflornitina (NECT) o la eflornitina sola parecen ser más eficaces y dar lugar a menos efectos secundarios. [36] Estos tratamientos pueden reemplazar al melarsoprol cuando esté disponible. [36] [2] El NECT tiene el beneficio de requerir menos inyecciones de eflornitina. [36]
El melarsoprol intravenoso era anteriormente el tratamiento estándar para la enfermedad en la segunda etapa (fase neurológica) y es eficaz para ambos tipos. [2] El melarsoprol es el único tratamiento para la segunda etapa de T. b. rhodesiense ; sin embargo, causa la muerte en el 5% de las personas que lo toman. [2] Puede producirse resistencia al melarsoprol. [2]
Proyectos de desarrollo de fármacos . Un desafío importante ha sido encontrar fármacos que pasen fácilmente la barrera hematoencefálica. El último fármaco que se ha utilizado clínicamente es el fexinidazol, pero también se han obtenido resultados prometedores con el fármaco benzoxaborol acoziborol (SCYX-7158). Este fármaco se está evaluando actualmente como tratamiento oral de dosis única, lo que supone una gran ventaja en comparación con los fármacos utilizados actualmente. Otro campo de investigación que se ha estudiado ampliamente en Trypanosoma brucei es el de dirigirse a su metabolismo de nucleótidos. [37] Los estudios del metabolismo de nucleótidos han llevado al desarrollo de análogos de adenosina que parecen prometedores en estudios con animales, y al hallazgo de que la regulación negativa del transportador de adenosina P2 es una forma común de adquirir resistencia parcial a fármacos contra las familias de fármacos melaminofenil arsenical y diamidina (que contienen melarsoprol y pentamidina, respectivamente). [37] La captación y degradación de fármacos son dos cuestiones importantes a tener en cuenta para evitar el desarrollo de resistencia a fármacos. En el caso de los análogos de nucleósidos, deben ser captados por el transportador de nucleósidos P1 (en lugar de P2) y también deben ser resistentes a la escisión en el parásito. [38] [39]
Si no se trata, la infección por T. b. gambiense casi siempre resulta mortal, y en un seguimiento a largo plazo de 15 años solo se ha demostrado que unos pocos individuos han sobrevivido tras rechazar el tratamiento. La T. b. rhodesiense , al ser una forma más aguda y grave de la enfermedad, es siempre mortal si no se trata. [2]
La progresión de la enfermedad varía mucho según la forma de la enfermedad. En el caso de las personas infectadas por T. b. gambiense , que representa el 92% de todos los casos notificados, una persona puede estar infectada durante meses o incluso años sin signos ni síntomas hasta que la enfermedad llega a una fase avanzada, cuando es demasiado tarde para recibir un tratamiento eficaz. En el caso de las personas afectadas por T. b. rhodesiense , que representa el 2% de todos los casos notificados, los síntomas aparecen en cuestión de semanas o meses tras la infección. La progresión de la enfermedad es rápida e invade el sistema nervioso central, causando la muerte en poco tiempo. [40]

En 2010, causó alrededor de 9.000 muertes, en comparación con las 34.000 de 1990. [7] A partir de 2000, los años de vida ajustados por discapacidad (9 a 10 años) perdidos debido a la enfermedad del sueño son 2,0 millones. [42] De 2010 a 2014, hubo un estimado de 55 millones de personas en riesgo de contraer tripanosomiasis africana gambiense y más de 6 millones de personas en riesgo de contraer tripanosomiasis africana rhodesiense . [43] En 2014, la Organización Mundial de la Salud informó de 3.797 casos de tripanosomiasis africana humana cuando el número previsto de casos era de 5.000. El número total de casos notificados en 2014 es una reducción del 86% con respecto al número total de casos notificados en 2000. [43]
La enfermedad se ha registrado en 37 países, todos ellos en el África subsahariana. Se presenta regularmente en el sudeste de Uganda y el oeste de Kenia, y mató a más de 48.000 africanos en 2008. [19] La República Democrática del Congo es el país más afectado del mundo, con el 75% de los casos de Trypanosoma brucei gambiense . [20] La población en riesgo es de unos 69 millones, de los cuales un tercio tiene un riesgo de "muy alto" a "moderado" y los dos tercios restantes un riesgo de "bajo" a "muy bajo". [5] El número de personas afectadas por la enfermedad ha disminuido. A este ritmo, la eliminación de la enfermedad del sueño es una posibilidad. La Organización Mundial de la Salud planea erradicar la enfermedad del sueño para 2030. [43] [44]

La enfermedad ha estado presente en África durante miles de años. [46] Debido a la falta de viajes entre los pueblos indígenas, la enfermedad del sueño en humanos se había limitado a zonas aisladas. Esto cambió después de que los traficantes de esclavos árabes ingresaran a África central desde el este, siguiendo el río Congo , y trajeran parásitos. La enfermedad del sueño gambiana viajó río arriba por el río Congo y luego más al este. [47]
Un escritor árabe del siglo XIV dejó la siguiente descripción del caso de un sultán del reino de Mali: "Su fin fue ser sobrecogido por la enfermedad del sueño ( illat an-nawm ), que es una enfermedad que frecuentemente afecta a los habitantes de estos países, especialmente a sus jefes. El sueño se apodera de uno de ellos de tal manera que es casi imposible despertarlo". [47]
El cirujano naval británico John Atkins describió la enfermedad a su regreso de África Occidental en 1734: [47]
El mal del sueño (común entre los negros) no da ningún otro aviso previo que una falta de apetito dos o tres días antes; duermen profundamente y tienen muy poco sentido y sensibilidad, pues tirar, golpear o azotar apenas despierta el sentido y la fuerza suficientes para moverse; y en el momento en que dejas de golpear, olvidas el dolor y vuelves a caer en un estado de insensibilidad, babeando constantemente por la boca como si estuvieras babeando profundamente; respiras lentamente, pero no de manera desigual ni resoplas. Los jóvenes son más propensos a él que los viejos; y el juicio generalmente pronunciado es la muerte, y el pronóstico rara vez falla. Si de vez en cuando uno de ellos se recupera, ciertamente pierde la poca razón que tenía y se vuelve idiota...
El cirujano naval francés Marie-Théophile Griffon du Bellay trató y describió casos mientras estuvo destinado a bordo del buque hospital Caravane en Gabón a fines de la década de 1860. [48]
En 1901, estalló una epidemia devastadora en Uganda , que mató a más de 250.000 personas, [49] incluidas aproximadamente dos tercios de la población de las zonas afectadas de la costa del lago. Según The Cambridge History of Africa , "se ha estimado que hasta la mitad de la gente murió de enfermedad del sueño y viruela en las tierras de ambas orillas del bajo río Congo ". [50]
El agente causal y el vector fueron identificados en 1903 por David Bruce , y las subespecies de los protozoos fueron diferenciadas en 1910. Bruce había demostrado anteriormente que T. brucei era la causa de una enfermedad similar en caballos y ganado que era transmitida por la mosca tsé-tsé ( Glossina morsitans ). [47]
El primer tratamiento eficaz, atoxyl , un fármaco a base de arsénico desarrollado por Paul Ehrlich y Kiyoshi Shiga , se introdujo en 1910, pero la ceguera era un efecto secundario grave.
La suramina fue sintetizada por primera vez por Oskar Dressel y Richard Kothe en 1916 para Bayer . Se introdujo en 1920 para tratar la primera etapa de la enfermedad. En 1922, la suramina se combinaba generalmente con triparsamida (otro fármaco organoarsénico pentavalente), el primer fármaco que ingresaba al sistema nervioso y era útil en el tratamiento de la segunda etapa de la forma gambiense. La triparsamida se anunció en el Journal of Experimental Medicine en 1919 y Louise Pearce del Instituto Rockefeller la probó en el Congo Belga en 1920. Se utilizó durante la gran epidemia en África occidental y central en millones de personas y fue el pilar de la terapia hasta la década de 1960. [51] El misionero médico estadounidense Arthur Lewis Piper participó activamente en el uso de triparsamida para tratar la enfermedad del sueño en el Congo Belga en 1925. [52]
La pentamidina , un fármaco muy eficaz para la primera etapa de la enfermedad, se utiliza desde 1937. [53] Durante la década de 1950, se utilizó ampliamente como agente profiláctico en África occidental, lo que llevó a una marcada disminución de las tasas de infección. En ese momento, se creía que la erradicación de la enfermedad estaba al alcance de la mano. [ cita requerida ] [51]
El organoarsenical melarsoprol (Arsobal), desarrollado en la década de 1940, es eficaz para las personas con enfermedad del sueño de segunda etapa. Sin embargo, entre el 3 y el 10 % de las personas a las que se inyecta presenta encefalopatía reactiva (convulsiones, coma progresivo o reacciones psicóticas) y entre el 10 y el 70 % de estos casos resulta en la muerte; puede causar daño cerebral en quienes sobreviven a la encefalopatía. Sin embargo, debido a su eficacia, el melarsoprol todavía se utiliza en la actualidad. La resistencia al melarsoprol está aumentando y actualmente se está investigando la terapia combinada con nifurtimox. [ cita requerida ]
La eflornitina (difluorometilornitina o DFMO), el tratamiento más moderno, fue desarrollado en la década de 1970 por Albert Sjoerdsma y se sometió a ensayos clínicos en la década de 1980. El fármaco fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos en 1990. [54] Aventis , la empresa responsable de su fabricación, detuvo la producción en 1999. En 2001, Aventis, en asociación con Médicos Sin Fronteras y la Organización Mundial de la Salud , firmó un acuerdo a largo plazo para fabricar y donar el fármaco. [ cita requerida ]
Además de la enfermedad del sueño, los nombres anteriores incluían letargo negro, maladie du sommeil (Fr), Schlafkrankheit (Ger), letargo africano, [55] y tripanosomiasis del Congo. [55] [56]
Se ha secuenciado el genoma del parásito y se han identificado varias proteínas como posibles dianas para el tratamiento farmacológico. El análisis del genoma también reveló la razón por la que ha sido tan difícil generar una vacuna para esta enfermedad. T. brucei tiene más de 800 genes que hacen que el parásito "mezcle y combine" proteínas para evadir la detección del sistema inmunológico. [57]
Se está estudiando el uso de una forma genéticamente modificada de una bacteria que se encuentra naturalmente en el intestino de los vectores como método para controlar la enfermedad. [58]
Recientes hallazgos indican que el parásito no puede sobrevivir en el torrente sanguíneo sin su flagelo . Este descubrimiento ofrece a los investigadores un nuevo ángulo desde el cual atacar al parásito. [59]
Se están investigando vacunas contra la tripanosomiasis .
Además, la Iniciativa Medicamentos para Enfermedades Olvidadas ha contribuido a la investigación sobre la enfermedad del sueño en África desarrollando un compuesto llamado fexinidazol . Este proyecto se inició originalmente en abril de 2007 y en él participaron 749 personas en la República Democrática del Congo y la República Centroafricana . Los resultados mostraron eficacia y seguridad en ambas etapas de la enfermedad, tanto en adultos como en niños ≥ 6 años y con un peso ≥ 20 kg. [60] La Agencia Europea de Medicamentos lo aprobó para la enfermedad en primera y segunda etapa fuera de Europa en noviembre de 2018. [61] El tratamiento fue aprobado en la República Democrática del Congo en diciembre de 2018. [62]
En las estadísticas de financiación actuales, la tripanosomiasis africana humana se agrupa con las infecciones por kinetoplastos, un grupo de protozoos flagelados . [63] Las infecciones por kinetoplastos incluyen la enfermedad del sueño africana, la enfermedad de Chagas y la leishmaniasis. En conjunto, estas tres enfermedades representaron 4,4 millones de años de vida ajustados por discapacidad (AVAD) y 70.075 muertes registradas adicionales cada año. [63] En el caso de las infecciones por kinetoplastos, la financiación total mundial para investigación y desarrollo fue de aproximadamente 136,3 millones de dólares en 2012. Cada una de las tres enfermedades, la enfermedad del sueño africana, la enfermedad de Chagas y la leishmaniasis, recibió aproximadamente un tercio de la financiación, que fue de unos 36,8 millones de dólares, 38,7 millones de dólares y 31,7 millones de dólares, respectivamente. [63]
En el caso de la enfermedad del sueño, la financiación se dividió en investigación básica, descubrimiento de fármacos, vacunas y diagnósticos. La mayor parte de la financiación se destinó a la investigación básica de la enfermedad: aproximadamente 21,6 millones de dólares se destinaron a esa labor. En cuanto al desarrollo terapéutico, se invirtieron aproximadamente 10,9 millones de dólares. [63]
Las fuentes de financiación más importantes para la investigación y el desarrollo de las infecciones por kinetoplastos son las públicas. Alrededor del 62% de la financiación proviene de países de altos ingresos, mientras que el 9% proviene de países de ingresos bajos y medios. La financiación pública de los países de altos ingresos es la que más contribuye a la investigación de las enfermedades desatendidas. Sin embargo, en los últimos años, la financiación procedente de los países de altos ingresos ha ido disminuyendo de forma constante: en 2007, los países de altos ingresos aportaron el 67,5% de la financiación total, mientras que en 2012 los fondos públicos de los países de altos ingresos sólo aportaron el 60% de la financiación total para las infecciones por kinetoplastos. Esta tendencia a la baja deja un vacío que otros financiadores, como las fundaciones filantrópicas y las empresas farmacéuticas privadas, deben llenar. [63]
Gran parte del progreso que se ha logrado en la investigación sobre la enfermedad del sueño y las enfermedades olvidadas en África en su conjunto es resultado de otros financiadores no públicos. Una de estas principales fuentes de financiación ha procedido de fundaciones, que cada vez se han comprometido más con el descubrimiento de fármacos para enfermedades olvidadas en el siglo XXI. En 2012, las fuentes filantrópicas proporcionaron el 15,9% de la financiación total. [63] La Fundación Bill y Melinda Gates ha sido líder en la financiación del desarrollo de fármacos para enfermedades olvidadas . Ha proporcionado 444,1 millones de dólares estadounidenses para la investigación de enfermedades olvidadas en 2012. Hasta la fecha, ha donado más de 1.020 millones de dólares estadounidenses para los esfuerzos de descubrimiento de enfermedades olvidadas. [64]
En el caso específico de las infecciones por kinetoplastos, han donado un promedio de 28,15 millones de dólares anuales entre los años 2007 y 2011. [63] Han calificado a la tripanosomiasis africana humana como un objetivo de alta oportunidad, lo que significa que es una enfermedad que presenta la mayor oportunidad de control, eliminación y erradicación mediante el desarrollo de nuevos medicamentos, vacunas, programas de salud pública y diagnósticos. Son la segunda fuente de financiación más importante para las enfermedades olvidadas, inmediatamente detrás de los Institutos Nacionales de Salud de Estados Unidos. [63] En un momento en el que la financiación pública está disminuyendo y las subvenciones gubernamentales para la investigación científica son más difíciles de obtener, el mundo filantrópico ha intervenido para impulsar la investigación. [ cita requerida ]
Otro componente importante del aumento del interés y la financiación ha venido de la industria. En 2012, contribuyeron con un 13,1% del total a la investigación y el desarrollo de los kinetoplastos, y además han desempeñado un papel importante al contribuir a las asociaciones público-privadas (APP) así como a las asociaciones para el desarrollo de productos (ADP). [63] Una asociación público-privada es un acuerdo entre una o más entidades públicas y una o más entidades privadas que existe para lograr un resultado sanitario específico o para producir un producto sanitario. La asociación puede existir de numerosas formas; pueden compartir e intercambiar fondos, propiedades, equipos, recursos humanos y propiedad intelectual. Estas asociaciones público-privadas y asociaciones para el desarrollo de productos se han establecido para abordar los desafíos de la industria farmacéutica, especialmente relacionados con la investigación de enfermedades desatendidas. Estas asociaciones pueden ayudar a aumentar la escala del esfuerzo hacia el desarrollo terapéutico mediante el uso de diferentes conocimientos, habilidades y experiencia de diferentes fuentes. Se ha demostrado que este tipo de asociaciones son más eficaces que la industria o los grupos públicos que trabajan de forma independiente. [65]
El tripanosoma , tanto del tipo rhodesiense como del gambiense, puede afectar a otros animales, como el ganado y los animales salvajes. [1] La tripanosomiasis africana se ha considerado generalmente una enfermedad antroponótica y, por lo tanto, su programa de control se centró principalmente en detener la transmisión mediante el tratamiento de los casos humanos y la eliminación del vector. Sin embargo, se informó que los reservorios animales posiblemente desempeñan un papel importante en la naturaleza endémica de la tripanosomiasis africana y en su resurgimiento en los focos históricos de África occidental y central. [66] [67]
{{cite journal}}: Requiere citar revista |journal=( ayuda )Véanse las págs. 154–5