La teoría polielectrolítica del gen propone que para que un biopolímero genético lineal disuelto en agua, como el ADN , experimente una evolución darwiniana en cualquier parte del universo, debe ser un polielectrolito , un polímero que contiene cargas iónicas repetidas . [1] Estas cargas mantienen las propiedades físicas uniformes necesarias para la evolución darwiniana, independientemente de la información codificada en el biopolímero genético . [1] [2] [3] El ADN es una de esas moléculas. Independientemente de su secuencia de ácidos nucleicos , las cargas negativas en su cadena principal dominan las interacciones físicas de la molécula hasta tal punto que mantiene propiedades físicas uniformes como su solubilidad en agua y su estructura de doble hélice . [1]
La teoría de los polielectrolitos del gen fue propuesta por Steven A. Benner y Daniel Hutter en 2002 [2] y ha permanecido en gran medida como un marco teórico que los astrobiólogos han utilizado para pensar cómo se puede detectar la vida más allá de la Tierra. Esta idea fue posteriormente vinculada por Benner [3] [1] a la visión de Erwin Schrödinger del gen como un " cristal aperiódico " [4] para formar un concepto sólido y universalmente generalizado de un biopolímero genético, un biopolímero que actúa como una unidad de herencia en la evolución darwiniana.
Benner y otros que se basaron en su trabajo [5] propusieron métodos para concentrar e identificar biopolímeros genéticos en otros planetas y lunas dentro del sistema solar utilizando electroforesis , que utiliza un campo eléctrico para concentrar compuestos cargados. [1] [2] [3]
Aunque pocos han puesto a prueba la teoría polielectrolítica del gen, en 2019, unos experimentos de laboratorio pusieron en tela de juicio la universalidad de esta idea. Este trabajo logró crear polímeros no electrolíticos capaces de una evolución darwiniana limitada, pero solo hasta una longitud de 72 nucleótidos. [6] [7]
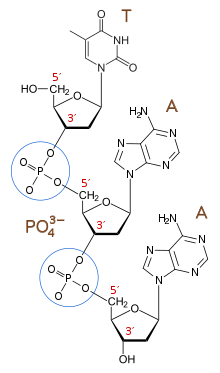
Un polielectrolito es un polímero con unidades repetidas cargadas electrostáticamente . En el contexto de la teoría polielectrolítica del gen, este polielectrolito es un biopolímero (un polímero derivado de un sistema vivo) con una unidad repetida cargada iónicamente, similar al biopolímero genético de la biología moderna, el ADN. Aunque el ARN no actúa como un archivo de biopolímeros genéticos en la biología moderna (excepto en el caso de algunos virus como el coronavirus [8] y el VIH [9] ), la hipótesis del mundo del ARN sugiere que el ARN puede haber precedido al ADN como el primer biopolímero genético de la vida [10] . Los bloques de construcción de nucleótidos que forman el ADN y el ARN están conectados por grupos fosfato con carga negativa. Estos enlaces fosfodiéster crean las cargas negativas repetidas en la estructura principal de la molécula que le dan al ADN y al ARN su naturaleza polielectrolítica [11] .
Para participar en la evolución darwiniana, que puede describirse como " descendencia con modificación ", [12] una unidad de herencia debe ser capaz de replicarse de manera imperfecta para producir ocasionalmente una nueva unidad de herencia modificada, que también debe ser capaz de replicarse. Esta replicación imperfecta conduce a la variación sobre la que puede actuar la evolución darwiniana. [13]
La teoría polielectrolítica del gen intenta comprender la unidad de herencia de la biología moderna, el ADN, a un nivel generalizable. En 2002, Steven A. Benner y Daniel Hutter identificaron las cargas repetidas en los enlaces fosfodiéster del ADN como cruciales para su función como biopolímero genético. Propusieron con la teoría polielectrolítica del gen que las cargas iónicas repetidas, positivas o negativas, son un requisito general para que todos los biopolímeros genéticos disueltos en agua experimenten una evolución darwiniana en cualquier parte del cosmos. [2]
Este concepto funciona en conjunto con la visión del gen como un "cristal aperiódico" propuesta por Erwin Schrödinger en su libro de 1944 " ¿Qué es la vida? ". [4] Un cristal aperiódico, como lo describe Schrödinger, tiene un conjunto discreto de bloques de construcción moleculares en una disposición no repetitiva. El ADN es un cristal aperiódico compuesto de nucleobases discretas ( A , T , C y G ), que se organizan en función de la información que codifican, no en ningún formato repetido. Si bien esta idea de un "cristal aperiódico" no estaba vinculada inicialmente a la teoría polielectrolítica del gen, Benner, en un trabajo posterior, conectó las dos. [3] [1]

En bioquímica , la estructura de una biomolécula dicta su función y, por lo tanto, los cambios en la estructura provocan cambios en la función. [14] Para funcionar como una unidad de herencia, el biopolímero genético debe mantener la forma y, por lo tanto, la consistencia física y química, independientemente de la información que codifique la estructura. El ADN es una de esas moléculas. No importa cuál sea la secuencia de ácidos nucleicos, el ADN mantiene una estructura de doble hélice consistente y, por lo tanto, las propiedades físicas consistentes que le permiten permanecer disuelto en agua y ser replicado por la maquinaria celular. La teoría polielectrolítica del gen razona que el ADN puede mantener su forma independientemente de las mutaciones porque las cargas negativas en la cadena principal de fosfato dominan las interacciones físicas de la molécula a tal grado que los cambios en la secuencia de ácidos nucleicos, la información codificada, no afectan el comportamiento físico general de la molécula. [2]
Por ejemplo, los nucleótidos de timidina (T) son muy solubles en agua, mientras que los nucleótidos de guanosina (G) son más insolubles; sin embargo, un oligonucleótido (una secuencia corta de polinucleótidos ) compuesto solo de timina y uno compuesto solo de guanina tienen la misma estructura general y propiedades físicas. [15] Si los cambios en la secuencia de ácidos nucleicos , que codifica la información genética, cambian las propiedades físicas del ADN, estos cambios podrían romper el mecanismo por el cual el ADN se replica .
Esta uniformidad física es muy rara en la naturaleza. Tomemos otro biopolímero, por ejemplo, las proteínas . La secuencia de ácido nucleico en el ADN codifica la secuencia de aminoácidos que forman las proteínas. Un cambio incluso en un solo aminoácido en la secuencia primaria de una proteína puede cambiar por completo las propiedades físicas de esa proteína. Por ejemplo, el rasgo de células falciformes es causado por una sola mutación de una adenina a una timina en el gen de la hemoglobina , lo que provoca un cambio de un ácido glutámico a una valina . [16] Esto cambia por completo la estructura tridimensional de la hemoglobina y, por lo tanto, cambia las propiedades físicas de la proteína que conducen al rasgo de células falciformes.
Las proteínas son sensibles a los cambios en la secuencia de aminoácidos porque las 20 cadenas laterales de aminoácidos diferentes forman enlaces y enlaces parciales entre sí. [17] Además, la estructura principal de la proteína tiene un momento dipolar (que tiene lados parcialmente positivos y parcialmente negativos) que puede crear interacciones dentro de la molécula. Estas interacciones entre la cadena lateral y la estructura principal son sensibles a los cambios en el entorno y la secuencia de aminoácidos. Es poco probable que una proteína pueda actuar como una biomolécula genética porque los cambios en la secuencia de aminoácidos conducen a cambios en la estructura física y las propiedades generales. [2]
Otro biopolímero no electrolítico se enfrentaría a los mismos desafíos que una proteína al actuar como biomolécula genética. Los cambios en las propiedades físicas con cambios en la información codificada significarían que dicha molécula tendría dificultades para replicarse con ciertas secuencias de información codificada, ya que esas secuencias darían como resultado propiedades físicas incompatibles con la replicación. Este problema significa que el gen proteico hipotético no podría explorar todas las secuencias genéticas posibles, ya que ciertas secuencias harían que la molécula no pudiera replicarse en función de la estructura física de su gen, no de la idoneidad de lo que el gen codifica. [2]
Benner y Hutter describieron inicialmente esta propiedad del ADN como "capaz de sobrevivir a modificaciones en su constitución sin perder propiedades esenciales para la replicación" o el acrónimo COSMIC-LOPER. Este acrónimo ofrece a los científicos una forma abreviada de describir la idea compleja de un biopolímero genético que tiene la uniformidad física independientemente de la información codificada que le permite replicarse. [2]
Aunque el ARN se describe a menudo como un biopolímero genético debido a su función teórica como la primera unidad de herencia de la vida (Mundo del ARN), no es completamente CÓSMICO-LOPER. El ARN, especialmente las secuencias ricas en guanina (G), es capaz de plegarse y realizar química de tipo enzimático . [2] [18] El plegamiento en secuencias de ARN ricas en guanina impide la capacidad de moldeo del ARN y, por lo tanto, su capacidad de replicarse en un escenario de mundo de ARN, por la misma razón por la que sería difícil que un gen basado en proteínas se replicara. [2]
Las cargas negativas repetidas aumentan la solubilidad del ADN y el ARN en agua. Debido a que las cargas iónicas son altamente solubles en agua, tenerlas en la cadena principal de la molécula aumenta la solubilidad de la molécula. [19] Si la cadena principal de un biopolímero genético hipotético estuviera unida de manera no iónica, la solubilidad de toda la molécula disminuiría. [20] La solubilidad es importante porque, para poder replicarse, el ADN (o cualquier otra biomolécula genética) debe ser soluble para interactuar con la maquinaria replicativa. [11]

Las cargas negativas repetidas de la cadena principal del ADN se repelen electrostáticamente entre sí, lo que impide las interacciones tanto dentro como entre las cadenas de ADN. Esta repulsión promueve interacciones específicas a lo largo del "borde" Watson-Crick de las nucleobases, lo que promueve la especificidad de emparejamiento de bases Watson-Crick : A se empareja con T y C se empareja con G. [2]

Las cargas negativas repetidas en la cadena principal evitan que el ADN y muchas moléculas de ARN se plieguen y les permiten actuar como plantillas. En el agua, las moléculas adoptan una conformación que es la más favorable energéticamente , con la energía libre de Gibbs más baja . [11] Esta configuración maximiza las interacciones favorables ( enlaces de hidrógeno , interacciones de carga positiva-negativa, interacciones de van der Waals ) y minimiza las interacciones desfavorables (es decir, interacciones hidrófilas-hidrófobas e interacciones de carga similar). En el caso del ADN y ARN bicatenarios , la forma energéticamente más favorable es la configuración de doble hélice lineal porque maximiza las interacciones entre pares de bases y entre la cadena principal cargada negativamente y las moléculas de agua circundantes, al tiempo que minimiza las interacciones entre los enlaces fosfodiéster cargados negativamente de la cadena principal. [11] Si la molécula de ADN o ARN bicatenario se plegara, intercambiaría interacciones favorables agua-cadena principal por interacciones desfavorables cadena principal-cadena principal. Un biopolímero sin una estructura principal cargada iónicamente, como las proteínas, no produciría una interacción desfavorable entre estructuras principales durante el plegamiento y, por lo tanto, se plegaría y agregaría fácilmente . Esta tendencia inherente hacia la linealidad mejora la capacidad del ADN para actuar como plantilla para la replicación [2] porque las conformaciones plegadas y agregadas son inaccesibles a la maquinaria de replicación.
Los experimentos de laboratorio realizados con análogos no electrolíticos del ADN y el ARN inspiraron inicialmente a Benner y Hutton a publicar sobre la teoría polielectrolítica del gen. [3] Durante finales de los años 80 y 90, los científicos desarrollaron moléculas sintéticas similares al ADN para unirse y silenciar los productos no deseados del gen ARNm como una forma de tratar la enfermedad. [2] [21] Como parte de esta investigación exploratoria, los investigadores desarrollaron una variedad de análogos de ARN y ADN no electrolíticos que serían capaces de atravesar la membrana celular , lo que el ADN y el ARN son incapaces de hacer debido a sus cadenas principales cargadas. Uno de estos análogos sustituyó una sulfona (SO₂) por el enlace fosfodiéster natural (PO₂⁻). Si bien los experimentos iniciales mostraron que el análogo de sulfona tenía propiedades muy similares al ADN como dímero (dos nucleótidos unidos entre sí), cuando se sintetizaron análogos de sulfona más largos, se plegaron, perdieron la especificidad del par de bases Watson-Crick y tuvieron cambios dramáticos en las propiedades físicas debido a pequeños cambios en la secuencia de ácidos nucleicos. [2] La reducción en la calidad de los rasgos que hacen del ADN una buena molécula genética se observó con todos los enlaces no iónicos que se probaron a partir de 2002. [2]
El análogo no electrolítico más cercano a mantener las cualidades del ADN fue el análogo de ácido nucleico ligado a poliamida (PNA), que reemplazó el enlace fosfodiéster del ADN con un enlace N-(2-aminoetil)glicina sin carga. Incluso Benner y Hutter cuestionaron si el PNA podría refutar su hipótesis de polielectrolito; sin embargo, aunque el PNA mantenía las cualidades del ADN hasta una longitud de 20 nucleótidos, más allá de esa longitud, las moléculas comenzaron a perder la especificidad de pares de bases de Watson-Crick, se agregaron y se volvieron sensibles a los cambios en la secuencia de ácidos nucleicos. [2]
En 2019, un grupo dirigido por Philipp Holliger en Cambridge, Inglaterra, desarrolló análogos de ADN de ácidos nucleicos P-alquilfosfonatos no electrolíticos (phNA) que pudieron experimentar una síntesis con plantilla y una evolución dirigida . [22] Los análogos de phNA sustituyeron el oxígeno cargado en la cadena principal de fosfato del ADN con un grupo metilo o etilo sin carga . Si bien se ha demostrado que otros análogos de ADN experimentan una síntesis con plantilla y una evolución dirigida, este descubrimiento fue la primera vez que se demostró que un análogo de ADN no electrolítico tenía estas propiedades y la primera vez que se cuestionó experimentalmente la teoría polielectrolítica del gen. [23] Sin embargo, la síntesis dirigida por plantilla de phNA solo se realizó hasta una longitud de 72 nucleótidos. [22] Esto es aproximadamente la longitud del gen natural más corto, el ARNt, [24] pero es aproximadamente un orden de magnitud más corto que el genoma del organismo libre más pequeño. [25] El genoma humano como referencia tiene una longitud de 3,05×10⁹ pares de bases. [26]
Desde sus inicios, la teoría de los polielectrolitos del gen se ha utilizado en el contexto de la búsqueda de vida en el universo. Esta teoría, combinada con la visión de Schrödinger de un gen como un cristal aperiódico, proporciona una denominada " biofirma agnóstica ", [1] un signo de vida que no presupone ninguna bioquímica. [27] En otras palabras, una visión generalizada de la vida debería ser válida en cualquier lugar del universo. [1]
Dado que las biomoléculas polielectrolitas genéticas teóricas podrían estar cargadas positiva o negativamente, como en el caso del ADN y el ARN, se pueden concentrar en agua con un campo eléctrico mediante electroforesis o electrodiálisis . Este dispositivo de concentración hipotético se ha denominado un dispositivo agnóstico para encontrar vida. [1] De manera similar a cómo funciona la electroforesis para separar las moléculas de ADN, las moléculas con carga negativa, como el ADN o el ARN, serían atraídas por un ánodo con carga positiva, y las biomoléculas genéticas con carga positiva serían atraídas por un cátodo con carga negativa. [15]
Una vez que se ha concentrado la biomolécula de polielectrolito, Benner sugiere que se pruebe la uniformidad de tamaño y forma de las moléculas. Además, se debe probar la utilización de un número limitado de bloques de construcción dispuestos de manera no repetitiva, una estructura cristalina aperiódica. [1] Benner ha sugerido que esto podría hacerse utilizando la desorción-ionización láser asistida por matriz (MALDI) emparejada con un espectrómetro de masas de alta resolución de orbitrap . [28] Otro enfoque sugerido ha sido utilizar la tecnología de secuenciación de nanoporos , aunque quedan dudas sobre si la radiación solar experimentada durante el tránsito y en el sitio afectaría la funcionalidad del dispositivo. [5] Si bien las agencias espaciales aún no han utilizado ninguno de estos sistemas propuestos para la detección de vida, es posible que se utilicen en el futuro en Marte, [28] Encélado, [1] y Europa. [5]
A pesar de que la teoría de los polielectrolitos y la teoría de los cristales aperiódicos se describen como biofirmas agnósticas, estas teorías se centran en la vida terrestre. No se sabe qué podría ser la vida en otro mundo; aunque a menudo se afirma que la vida de cualquier tipo necesita biomoléculas y agua, esto puede no ser cierto. [19]