El patch clamping automatizado está comenzando [1] a reemplazar al patch clamping manual como método para medir la actividad eléctrica de células individuales . Se utilizan diferentes técnicas para automatizar los registros de patch clamp de células en cultivos celulares e in vivo . Este trabajo se ha estado realizando desde fines de la década de 1990 por parte de laboratorios de investigación y empresas que intentan reducir su complejidad y costo del patch clamping manual. Durante mucho tiempo, el patch clamping se consideró una forma de arte y todavía requiere mucho tiempo y es tedioso, especialmente in vivo. Las técnicas de automatización intentan reducir el error del usuario y la variabilidad en la obtención de registros electrofisiológicos de calidad de células individuales.
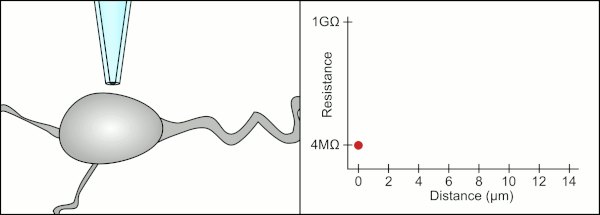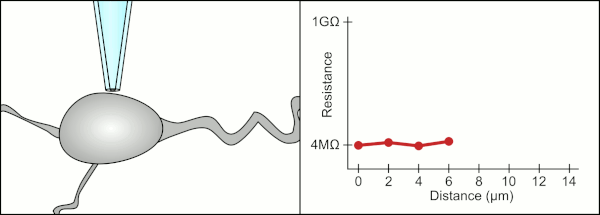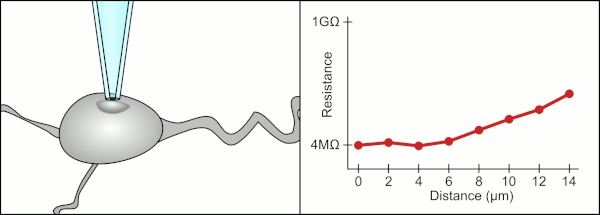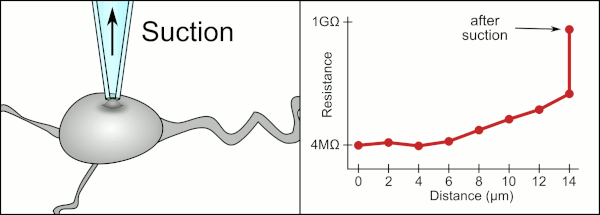
El método manual tradicional para realizar la fijación con pinzas de parche mediante pipetas de vidrio fue desarrollado por Erwin Neher y Bert Sakmann y requería de un técnico altamente calificado. El técnico colocaba la pipeta de vidrio cerca de una célula y aplicaba la succión adecuada para crear un sello eléctrico entre la pipeta y la membrana celular. Este sello garantiza un registro de calidad al evitar que se escape corriente entre la punta de la pipeta y la membrana celular. Este sello se realiza cuando la membrana de la célula se une químicamente con la punta de la pipeta de modo que el interior de la pipeta solo está conectado al citoplasma de la célula. Esta conexión o sello entre la membrana y el vidrio se denomina "gigasello". [2]
Tradicionalmente, el técnico utilizaba su boca para proporcionar las presiones precisas necesarias para sellar la membrana a la célula. Además de controlar la presión, el técnico también debe colocar la pipeta a la distancia precisa de la célula para que la membrana se selle con ella. Utilizando un micromanipulador , la pipeta se mueve hacia la célula hasta que el técnico ve un cambio en la resistencia eléctrica entre el fluido dentro de la pipeta y el fluido circundante (ver animación). Esto normalmente requiere de 3 a 12 meses de capacitación antes de que un técnico pueda registrar de manera confiable desde las células. El técnico esencialmente está realizando un acto de equilibrio tratando de observar y manipular varios sistemas simultáneamente (movimiento, presión y señales eléctricas). A menos que cada parte del proceso se realice con precisión y en el momento adecuado, el sello no se formará correctamente y el técnico tendrá que reemplazar la pipeta y comenzar de nuevo.
Estos desafíos reducen la cantidad de registros que puede obtener un técnico y aumentan significativamente el costo. La automatización busca reducir el tiempo, la complejidad y el costo de la fijación manual de parches. Mejorar el rendimiento también será clave para permitir una secuenciación de parches de alto rendimiento para combinar simultáneamente la electrofisiología , la morfología y las propiedades transcriptómicas de las neuronas a una escala comparable a otros métodos de secuenciación [3].
La técnica de automatización varía según el entorno que rodea a las células. En el caso de las células in vivo, esto suele significar que las células están en el cerebro y rodeadas de otras células. Este entorno también contiene vasos sanguíneos , dendritas , axones y células gliales que dificultan la formación de un gigasello al obstruir la punta de la pipeta de 1-2 μm de diámetro. En este caso, el control preciso de la presión y la posición en la punta de la pipeta desempeña un papel importante a la hora de evitar obstrucciones y detectar si una célula está cerca de la punta de la pipeta, como se ha comentado anteriormente.
Las células in vitro pueden suspenderse en un líquido, adherirse a una placa de cultivo o permanecer como parte de un trozo de tejido extraído del animal. Estos entornos normalmente no tienen que compensar el movimiento del tejido debido al latido del corazón o la respiración de un animal. En el caso de las células en suspensión, la pipeta se reemplaza completamente por un microchip con orificios que pueden crear gigasellos y medir la actividad eléctrica. La obstrucción también es menos problemática para las células o el tejido en placas de cultivo porque las células y la pipeta se pueden ver a través de un microscopio, lo que ayuda al técnico a evitar todo excepto la célula de interés.
Cada uno de estos sistemas automatizados debe realizar varias tareas: colocar la celda junto a la punta de una pipeta o de algún otro dispositivo con un orificio de 1-2 μm, controlar la presión en el orificio y controlar el voltaje dentro de la celda.
Un ejemplo de fijación de parche in vivo fue mostrado por Kodandaramaiah, et al. [4] En este caso, el control de presión consistió en un conjunto de válvulas electrónicas y reguladores electrónicos de presión para proporcionar tres presiones que previamente fueron proporcionadas por un técnico (alta presión 800-1000mbar, baja presión 20-30mbar y un pequeño vacío 15-150mbar). Tres válvulas electrónicas cambiaron entre las tres presiones y la presión atmosférica. La alta presión se utilizó para evitar obstruir la pipeta, la baja presión se utilizó para buscar células y el vacío se utilizó para ayudar al proceso de sellado gigas. Todos estos fueron controlados por una computadora, para seleccionar entre las presiones a medida que cambiaba la resistencia en la punta de la pipeta.
En este caso, el control de posición manual se sustituyó por un micromanipulador piezoeléctrico controlado por ordenador que movía la pipeta en pasos discretos de 2 a 3 μm en el tejido hasta que hacía contacto con una célula. Este control de precisión es mucho más exacto y repetible que el posicionamiento manual y no requiere un operador.
El ordenador también calcula y sigue el cambio de la resistencia eléctrica cuando la pipeta entra en contacto con la célula. Envía una señal de voltaje en forma de onda cuadrada por la pipeta que sale por el extremo de la pipeta o es bloqueada por la membrana celular. Cuando la membrana la bloquea, el ordenador detiene el movimiento de la pipeta y aplica succión para formar el gigasello. Esta automatización elimina la toma de decisiones que tenía que realizar un técnico y, a diferencia de un técnico, el ordenador puede realizar estas tareas incansablemente y con mayor precisión.
Todos estos pasos se realizan en la misma secuencia lógica que el patch clamping manual, pero no requieren una formación extensa para su realización y están completamente controlados por la computadora. Esto reduce el gasto necesario para obtener grabaciones de patch clamp y aumenta la repetibilidad y la solidez de las grabaciones en el cerebro vivo.


Se han desarrollado muchos tipos de sistemas para la fijación de parches de células en cultivos en suspensión. Un sistema utiliza una pipeta tradicional y células en un cultivo en suspensión de gotitas para obtener registros de fijación de parches (ver figura). Esto tiene el beneficio adicional de utilizar sistemas tradicionales de fabricación de pipetas que calientan un capilar de vidrio y lo tiran a lo largo para crear la punta cónica que se utiliza en la fijación de parches.
Los sistemas de automatización más comunes para cultivos en suspensión utilizan microchips con orificios diminutos (1-2 μm) en un sustrato plano en lugar de pipetas para crear el gigasello y registrar a partir de células individuales. Los chips de parche se desarrollaron a principios de la década de 2000 como resultado de la mejora de las tecnologías de microfabricación desarrolladas por la industria de semiconductores . Los chips suelen estar hechos de silicio , vidrio , PDMS y poliamida . Los sistemas de chip de parche suelen ser más complejos y costosos, pero tienen el beneficio adicional de un funcionamiento en paralelo y sin manos. [5] [6] [7]
Por lo general, las neuronas no crecen en cultivos en suspensión, pero otros tipos de células sí pueden hacerlo. Algunas pueden ser transfectadas con genes para crear los canales iónicos de membrana de interés. Esto significa que una célula que normalmente no tiene actividad eléctrica puede desarrollar canales iónicos en su membrana que generarán corrientes iónicas. Debido a que las células están disociadas entre sí en cultivos en suspensión, las corrientes iónicas en una sola célula se pueden medir con precisión. Esto permite a los investigadores estudiar el comportamiento de los canales iónicos en entornos más controlados sin que interfieran las corrientes de otras células, como suele ocurrir en las redes neuronales. Esto es particularmente útil en estudios de detección de fármacos donde el objetivo es una proteína específica. [8] Debido a que manipular células en suspensión es mucho más fácil que manipular células en cultivo o in vivo, los registros de fijación de parche se pueden obtener de forma mucho más rápida y fiable de esta manera, lo que aumenta la productividad, haciendo posible la detección de miles de compuestos. [9]
Las neuronas derivadas de células madre cultivadas de forma adherente se pueden suspender y se han utilizado con éxito en dispositivos de fijación de parche planares. [10] Los canales iónicos, como los canales de sodio dependientes de voltaje , los canales de potasio dependientes de voltaje y los canales iónicos dependientes de ligando ionotrópico abiertos por el ligando GABA, se registraron a partir de estas células utilizando una fijación de parche automatizada y manual. [11]
Existen muchos métodos in vitro para la fijación automatizada de parches de células cultivadas o cortes de tejido cerebral.
Se utiliza un chip de parche, como los discutidos anteriormente, junto con tratamientos de superficie que hacen que las células cultivadas migren a los orificios donde se forma el gigasello a medida que crecen. [12] Al permitir que las neuronas crezcan en cultivo, forman redes espontáneamente, como las del cerebro, que se parecen más a los tejidos naturales que a las células aisladas en suspensión.
En otro método, se extraen células de un animal y se cultivan en el chip de parche durante 2 a 4 horas mientras forman espontáneamente gigasellos con chips de parche de poliimida y PDMS [13]. Este sistema no requiere equipo externo para formar gigasellos.
Otra técnica automatiza la colocación de las células sujetas por el parche en los cultivos. Utiliza una nanopipeta en una platina precisa accionada por piezo para escanear una superficie dentro de una placa de cultivo. Mientras escanea, mantiene una capacitancia eléctrica constante entre la punta de la pipeta y la superficie o las células debajo de ella moviéndola hacia arriba y hacia abajo. (A medida que se acerca a una célula, la capacitancia aumenta, por lo que el actuador aleja la pipeta, y viceversa). Esto proporciona un mapeo topográfico preciso de la superficie dentro de la placa de cultivo. Una vez que se han mapeado las células, la computadora mueve la pipeta hacia una célula seleccionada y la baja para formar un gigasello con ella. [14]
Otra técnica consiste simplemente en automatizar el proceso de establecer un contacto cuidadoso con las células. El operador coloca una pipeta sobre la muestra y luego deja que el software automatizado tome el control, bajando la pipeta y tratando de detectar un aumento de la resistencia en la pipeta a medida que hace contacto con una célula. En este punto, el proceso finaliza y un técnico crea el gigasello manualmente.
La instrumentación de automatización de fijación de parches se comercializó en 2003. Debido al alto costo inicial, esta tecnología de casi 20 años de antigüedad originalmente estaba destinada a servir a las industrias biotecnológica y farmacéutica, pero desde entonces también se ha utilizado en el ámbito académico y en entornos sin fines de lucro, en conexión y coexistiendo con otras tecnologías y métodos asociados o complementarios. [15] La aceptación y el reconocimiento de la electrofisiología de automatización de fijación de parches se ha reflejado en el crecimiento de la literatura científica publicada con esta tecnología [16]