La síntesis de piridina de Kröhnke es una reacción de síntesis orgánica entre sales de metilcetona de α-piridinio y compuestos carbonílicos α, β-insaturados que se utilizan para generar piridinas altamente funcionalizadas . Las piridinas se encuentran ampliamente presentes en productos naturales y sintéticos, por lo que existe un gran interés en las rutas para su síntesis. El método recibe su nombre en honor a Fritz Kröhnke.
En su trabajo en la Universidad de Giessen , Kröhnke observó la condensación de sales de metilcetona de α-piridinio 1 con compuestos carbonílicos α,β-insaturados 2 a través de una reacción de Michael cuando se trataron con acetato de amonio para dar piridinas 2,4,6-trisustituidas con altos rendimientos en condiciones de reacción suaves. [1] Los intermedios propuestos, el compuesto 1,5-dicarbonílico 3 , no han sido aislados. [2] Desde su descubrimiento, la síntesis de Kröhnke ha disfrutado de una amplia aplicabilidad para la preparación de derivados de di-, tri- y tetrapiridina, demostrando una serie de ventajas sobre reacciones relacionadas como la síntesis de piridina de Hantzsch .

El mecanismo de la síntesis de piridina de Kröhnke comienza con la enolización de la metilcetona de α-piridinio 4 seguida de la adición 1,4 a la cetona α, β-insaturada 5 para formar el aducto de Michael 6 , que inmediatamente se tautomeriza al 1,5-dicarbonilo 7. La adición de amoníaco a 7 seguida de la deshidratación a través de 8 genera el intermedio de imina 9. , [3] [4] El intermedio de imina luego se desprotona a la enamina 10 y se cicla con el carbonilo para generar el intermedio 11. Luego, el catión de piridinio se elimina para formar hidroxi-dienamina 12. La aromatización de 12 a través de la pérdida posterior de agua genera el heterociclo de piridina deseado 13 .

Los materiales de partida para la síntesis de Kröhnke suelen ser fáciles de preparar, lo que contribuye a la conveniencia y al amplio alcance del método. La preparación de las sales de metilcetona de α-piridinio se puede lograr fácilmente mediante el tratamiento de la bromometilcetona correspondiente con piridina. Las cetonas α,β-insaturadas suelen estar disponibles comercialmente o se pueden preparar utilizando varios métodos conocidos. Además, las bases de Mannich también se pueden utilizar como aceptor de Michael para el esquema, lo que diversifica aún más el alcance de los materiales de partida que se pueden incorporar al esquema de Kröhnke. [5]
Las condiciones de reacción para la síntesis de Kröhnke son generalmente fáciles y las reacciones a menudo se llevan a cabo con altos rendimientos con temperaturas de reacción que generalmente no superan los 140 °C. [6] La síntesis de Kröhnke generalmente se realiza en ácido acético glacial o metanol, pero también se puede realizar en condiciones acuosas y, más recientemente, en condiciones libres de solventes.
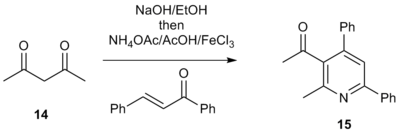
También se ha demostrado que los compuestos de 1,3-dicarbonilo son materiales de partida viables en lugar de las sales de metilcetona de α-piridinio. [7] Por ejemplo, el tratamiento de la 1,3-dicetona 14 con una base en etanol seguido de acetato de amonio, ácido acético, la enona correspondiente y un ácido de Lewis produce 3-aciltriarilpiridinas de la forma 15. Estas acilpiridinas son intermediarios atractivos porque tienen un asa electrofílica que permite incorporar funcionalidad adicional a la molécula. Esto permite la construcción sencilla de sistemas poliarílicos complejos, un método atractivo para la síntesis de bibliotecas de dianas farmacológicas que contienen fracciones de piridina funcionalizadas.
La síntesis de Kröhnke para producir piridinas posee una serie de ventajas concisas sobre otros métodos. A diferencia de la síntesis de Hantzsch, [8] el método de Kröhnke no requiere oxidación para generar el producto deseado, ya que la metilcetona de α-piridinio ya posee el estado de oxidación correcto.
Otra ventaja de la síntesis de Kröhnke es su alta economía de átomos . Por ejemplo, la síntesis de Chichibabin requiere 2 equivalentes de material de partida insaturado. [9] Además, los subproductos de la síntesis de Kröhnke son agua y piridina, lo que permite protocolos de procesamiento y purificación fáciles. A diferencia de los métodos comparables para la síntesis de piridina, la síntesis de Kröhnke se beneficia de ser una síntesis de un solo paso de alto rendimiento, lo que en última instancia permite la abreviatura de las vías sintéticas y simplifica aún más la catalogación de bibliotecas combinatorias.
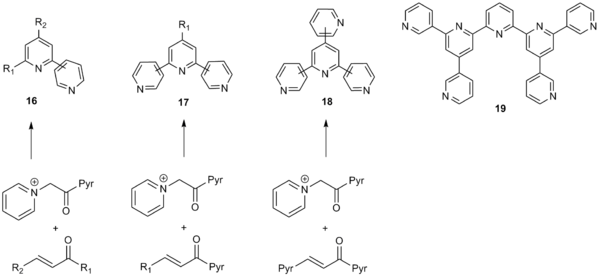
El amplio alcance de la síntesis de piridina de Kröhnke la ha hecho particularmente útil para la síntesis de sistemas de poliarilo, incluyendo también fracciones de piridilos, tienilos y furanilos . El método tolera una amplia gama de sustituyentes de arilo tanto en el fragmento de metilcetona de α-piridinio como en los compuestos carbonílicos α, β-insaturados y, por lo tanto, se puede utilizar para generar un amplio catálogo de sistemas de poliarilo. Además, los grupos atractores de electrones y los grupos donadores de electrones en los sustituyentes de arilo entrantes son bien tolerados. La síntesis de Kröhnke también puede emplear sustituyentes de alquilo y vinilo, lo que también da rendimientos moderados a buenos. [10] Debido a su amplio alcance, el método de Kröhnke ha tenido una amplia aplicabilidad para la síntesis de bipiridinas ( 16 ), terpiridinas ( 17 ), cuaterpiridinas ( 18 ) e incluso hasta septipiridinas ( 19 ), como se muestra a continuación. [11]
El método de Kröhnke se presenta en una síntesis sin solvente de triarilpiridinas que se realiza a través de un homoacoplamiento de dos compuestos carbonílicos α, β-insaturados sustituidos con diarilo. [12] Esta estrategia ofrece un medio fácil para la preparación de sistemas de arilo de piridilo que son fragmentos importantes de muchos andamiajes de fármacos útiles.

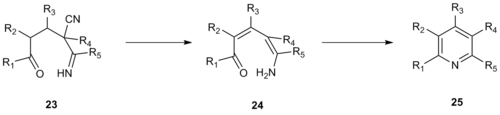
En 1992, Robinson y sus colaboradores desarrollaron una síntesis de piridina similar utilizando enaminonitrilos como uno de los fragmentos de tres carbonos en lugar de una metilcetona de α-piridinio. [13] Esta mejora aumenta la reactividad del sistema y permite la formación de piridinas completamente sustituidas, mientras que el uso de una metilcetona de α-piridinio requiere que la posición 3 o 5 de la piridina resultante no esté sustituida. La condensación de Kröhnke del enaminonitrilo 20 con la enona 21 produjo la piridina fusionada 22 .

El mecanismo de esta reacción de tipo Kröhnke probablemente procede a través de una cianamida viníloga 23 que sufre eliminación de ácido cianhídrico , desprotonación para formar enamina 24 y ciclización para formar el intermedio 25 , que luego se deshidrata para formar el producto de piridina deseado.
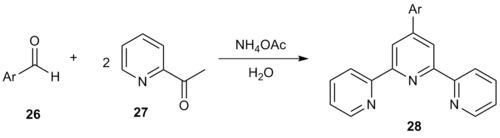
Un método Kröhnke limpio de un solo recipiente en medios acuosos genera 4'-aril-2,2':6', 2''-terpiridinas. [14] La reacción del aldehído arílico 26 con dos equivalentes de 2-acetilpiridina ( 27 ) produjo terpiridinas de la forma 28 .
Además de las variaciones del método original, se han empleado varios estudios combinatorios que utilizan la síntesis de Kröhnke y sus variaciones para sintetizar vastas bibliotecas de piridinas altamente funcionalizadas. Janda y sus colaboradores utilizaron el esquema general de reacción de Kröhnke para generar una biblioteca de 220 compuestos. [15] Varias metilcetonas 29 y aldehídos 30 se acoplaron mediante condensación aldólica para dar enonas de la forma 31. A continuación, estos compuestos se hicieron reaccionar con varias metilcetonas de α-piridinio 32 para dar la piridina trisustituida deseada 33 .
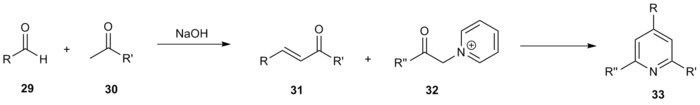
En 2009, Tu y colaboradores desarrollaron una estrategia combinatoria de 3 fragmentos en un solo paso para desarrollar 3-cianoterpiridinas 34 y 1-amino-2-acilterpiridinas 35. [16] Estas variaciones combinatorias de la reacción de Kröhnke proporcionan una estrategia sintética eficiente para los andamiajes de poliarilpiridina. Esta metodología también sería ventajosa para ensayos biológicos y experimentos de detección.

La metodología de Kröhnke también se ha utilizado para generar una serie de ligandos de unión a metales interesantes, ya que los complejos de polipiridilo como la bipiridina (bipy) se han utilizado ampliamente como ligandos. La síntesis de Kröhnke se utilizó para preparar una familia de ligandos de tipo N, S basados en tetrahidroquinolina. [17] La 2-tiofenilacetofenona ( 36 ) se hizo reaccionar con gas yodo y piridina con un rendimiento cuantitativo para generar yoduro de acilmetilpiridinio 37. La reacción con una cetona α, β-insaturada cíclica quiral derivada de 2-(+)-careno produjo el ligando de tipo N, S deseado 38 .

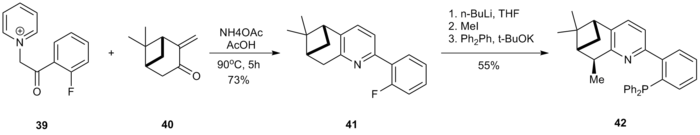
Se han preparado nuevos ligandos P, N quirales utilizando el método de Kröhnke. [18] La sal de acilcetona de α-piridinio 39 se cicló con el derivado de pinocarvona 40 para generar piridina 41. La posición bencílica de 41 se metiló y la posterior reacción de SnAr con difenilfosfuro de potasio generó el ligando 42 .
La reacción de Kröhnke también ha sido aplicable a la síntesis de varios compuestos biológicamente activos, además de los catalogados en estudios combinatorios. Kelly y sus colaboradores desarrollaron una ruta para la ciclo-2,2′:4′,4′′:2′′,2′′′:4′′′,4′′′′:2′′′′,2′′′′′:4′′′′,4-sexipiridina utilizando las reacciones de Kröhnke como el paso clave de macrociclización . [19] El complejo de polipiridina 43 se trató con N-bromosuccinimida en tetrahidrofurano húmedo seguido de piridina para generar la sal de acilmetilpiridinio 44 que luego puede sufrir la macrociclización en condiciones estándar para producir el producto deseado 45. El método de Kröhnke en esta síntesis fue crucial debido al fracaso de otras técnicas de ciclización como el acoplamiento de Glaser o el acoplamiento de Ullmann .

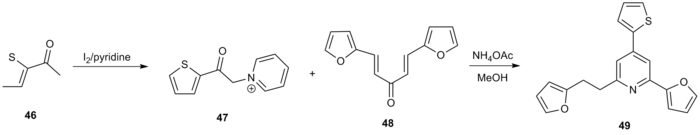
Otro uso de la síntesis de piridina de Kröhnke fue la generación de una serie de piridinas 2,4,6-trisustituidas que se investigaron como posibles inhibidores de la topoisomerasa 1. [20] El 2-acetiltiofeno ( 46 ) se trató con yodo y piridina para generar α-piridinio acil cetona 47. La reacción con el aceptor de Michael 48 en condiciones estándar produjo piridina funcionalizada 49 con un rendimiento general del 60%.
En definitiva, la síntesis de piridina de Kröhnke ofrece un enfoque sencillo y directo para la síntesis de una amplia gama de piridinas funcionalizadas y sistemas de poliarilo. La metodología de Kröhnke se ha aplicado a una serie de estrategias para obtener ligandos interesantes y moléculas biológicamente relevantes. Además, la reacción de Kröhnke y sus variaciones ofrecen una serie de ventajas en comparación con los métodos alternativos para la síntesis de piridina, que van desde variaciones sin disolventes orgánicos en un solo recipiente hasta una alta economía de átomos.