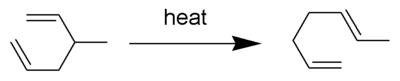
El reordenamiento de Cope es una reacción orgánica ampliamente estudiada que implica el reordenamiento [3,3]-sigmatrópico de 1,5- dienos . [1] [2] [3] [4] Fue desarrollado por Arthur C. Cope y Elizabeth Hardy . Por ejemplo, el 3-metil-hexa-1,5-dieno calentado a 300 °C produce hepta-1,5-dieno.
El reordenamiento de Cope provoca los estados fluxionales de las moléculas de la familia bullvaleno .
El reordenamiento de Cope es el ejemplo prototípico de un reordenamiento sigmatrópico concertado. Se clasifica como un reordenamiento [3,3]-sigmatrópico con el símbolo de Woodward-Hoffmann [ π 2 s + σ 2 s + π 2 s ] y, por lo tanto, está permitido térmicamente. A veces es útil pensar en él como si pasara por un estado de transición energéticamente y estructuralmente equivalente a un dirradical , aunque el dirradical no suele ser un verdadero intermedio (mínimo de energía potencial). [5] El estado de transición de silla ilustrado aquí es preferido en sistemas de cadena abierta (como lo muestran los experimentos de Doering-Roth). Sin embargo, los sistemas conformacionalmente restringidos como los cis -1,2-divinil ciclopropanos pueden experimentar el reordenamiento en la conformación de bote.
Actualmente se acepta generalmente que la mayoría de los reordenamientos de Cope siguen una ruta concertada permitida a través de un estado de transición aromático de Hückel y que no se forma un intermedio dirradical. Sin embargo, la reacción concertada a menudo puede ser asincrónica y los sistemas perturbados electrónicamente pueden tener un carácter dirradical considerable en el estado de transición. [6] A continuación se presenta una ilustración representativa del estado de transición del reordenamiento de Cope del hexa-1,5-dieno electrónicamente neutro . Aquí se puede ver que los dos enlaces π se están rompiendo mientras se forman dos nuevos enlaces π, y simultáneamente el enlace σ se está rompiendo mientras se forma un nuevo enlace σ. A diferencia del reordenamiento de Claisen , los reordenamientos de Cope sin liberación de tensión o perturbación electrónica a menudo son cercanos a la neutralidad térmica y, por lo tanto, pueden alcanzar solo una conversión parcial debido a una constante de equilibrio insuficientemente favorable . En el caso del hexa-1,5-dieno, el reordenamiento es degenerado (el producto es idéntico al material inicial), por lo que K = 1 por necesidad.
En los dienos asimétricos a menudo es necesario considerar la estereoquímica, que en el caso de las reacciones pericíclicas, como el reordenamiento de Cope, se puede predecir con las reglas de Woodward-Hoffmann y la consideración de la preferencia por la geometría del estado de transición de silla.
La transposición se utiliza ampliamente en la síntesis orgánica. Es simétrica, es decir, se permite cuando es suprafacial en todos los componentes. El estado de transición de la molécula pasa por un estado de transición tipo bote o silla. Un ejemplo de la transposición de Cope es la expansión de un anillo de ciclobutano a un anillo de cicloocta-1,5-dieno :

En este caso, la reacción debe pasar por el estado de transición de barco para producir los dos dobles enlaces cis . Un doble enlace trans en el anillo sería demasiado tenso . La reacción se produce en condiciones térmicas. La fuerza impulsora de la reacción es la pérdida de tensión del anillo de ciclobutano.
En 2016 se informó por primera vez sobre un reordenamiento organocatalítico de Cope. En este proceso, se utiliza un 1,5-dieno sustituido con aldehído, lo que permite lograr una "catálisis de iminio" utilizando un catalizador de hidrazida y alcanzar niveles moderados de enantioselectividad (hasta 47 % ee). [7]
Varias enzimas catalizan el reordenamiento de Cope, aunque su ocurrencia es rara en la naturaleza. [8] [9]
En el reordenamiento oxi-Cope , se añade un grupo hidroxilo en C3 formando un enal o enona después del tautomerismo ceto-enólico del enol intermedio. [10] [11] [12]

En su implementación original, la reacción de oxi-Cope requería altas temperaturas. Trabajos posteriores demostraron que los alcóxidos de potasio correspondientes se reorganizaban más rápido de 10 10 a 10 17 . [13] En virtud de esta innovación, la reacción se desarrolla bien a temperatura ambiente o incluso a 0 °C. Normalmente se emplean hidruro de potasio y 18-corona-6 para generar el alcóxido de potasio disociado: [14]

El diastereómero del material de partida que se muestra arriba con un grupo vinilo ecuatorial no reacciona, lo que proporciona evidencia de la naturaleza concertada de esta reacción. Sin embargo, se cree que el estado de transición de la reacción tiene un alto grado de carácter dirradical. En consecuencia, la reacción oxi-Cope acelerada por aniones puede proceder con alta eficiencia incluso en sistemas que no permiten una superposición orbital eficiente , como lo ilustra un paso clave en la síntesis de periplanona B : [15]
![Ejemplo de [Stuart Schreiber]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/Schreiber.png/600px-Schreiber.png)
Los reordenamientos neutros correspondientes de oxi-Cope y siloxi-Cope fallaron, dando lugar únicamente a productos de eliminación a 200 °C.
Otra variación del reordenamiento de Cope son los reordenamientos aza-Cope .