La aminación reductora (también conocida como alquilación reductora ) es una forma de aminación que implica la conversión de un grupo carbonilo en una amina a través de un intermediario imina . El grupo carbonilo es más comúnmente una cetona o un aldehído . Es un método común para producir aminas y se usa ampliamente en la química verde , ya que se puede hacer catalíticamente en un solo recipiente en condiciones suaves. En bioquímica, las enzimas deshidrogenasas usan aminación reductora para producir el aminoácido glutamato. Además, hay investigaciones en curso sobre mecanismos de síntesis alternativos con varios catalizadores metálicos que permiten que la reacción requiera menos energía y condiciones de reacción más suaves. La investigación sobre biocatalizadores, como las imina reductasas , ha permitido una mayor selectividad en la reducción de aminas quirales, que es un factor importante en la síntesis farmacéutica. [1]

La aminación reductora ocurre entre un carbonilo como un aldehído o cetona y una amina en presencia de un agente reductor . [2] Las condiciones de reacción son neutras o débilmente ácidas. [2]

La amina reacciona primero con el grupo carbonilo para formar una especie hemiaminal que posteriormente pierde una molécula de agua de manera reversible por bisustitución de alquilimino-de-oxo para formar el intermedio imina. [3] El equilibrio entre aldehído/cetona e imina se desplaza hacia la formación de imina por deshidratación. [2] Esta imina intermedia puede luego aislarse y reducirse con un agente reductor adecuado (por ejemplo, borohidruro de sodio ) para producir el producto de amina final. [2] La aminación reductora intramolecular también puede ocurrir para proporcionar un producto de amina cíclica si la amina y el carbonilo están en la misma molécula del material de partida. [4]
Hay dos formas de llevar a cabo una reacción de aminación reductora: directa e indirecta. [2]
En una reacción directa, los materiales de partida carbonilo y amina y el agente reductor se combinan y las reducciones se realizan secuencialmente. [2] Estas son a menudo reacciones de una sola etapa ya que el intermedio imina no se aísla antes de la reducción final al producto. [2] En cambio, a medida que avanza la reacción, la imina se ve favorecida para la reducción sobre el material de partida carbonilo. [2] Los dos métodos más comunes para la aminación reductora directa son la hidrogenación con catalizadores catalíticos de platino, paladio o níquel y el uso de agentes reductores de hidruro como el cianoborohidruro (NaBH 3 CN). [2]
La aminación reductora indirecta, también llamada reducción gradual, aísla el intermedio imina. [2] En un paso separado, el intermedio imina aislado se reduce para formar el producto amina. [2]
Hay muchas consideraciones que deben tenerse en cuenta al diseñar una reacción de aminación reductora. [5]
Para resolver el último problema, se pueden utilizar reacciones de aminación reductora asimétrica para sintetizar un producto enantiopuro de aminas quirales. [5] En la aminación reductora asimétrica, se utiliza un carbonilo que se puede convertir de aquiral a quiral. [6] El carbonilo sufre condensación con una amina en presencia de H2 y un catalizador quiral para formar el intermedio imina, que luego se reduce para formar la amina. [6] Sin embargo, este método todavía es limitante para sintetizar aminas primarias que no son selectivas y propensas a la sobrealquilación. [6]
El NaBH4 reduce tanto las iminas como los grupos carbonilo. [3] Sin embargo, no es muy selectivo y puede reducir otros grupos funcionales reducibles presentes en la reacción. [3] Para garantizar que esto no ocurra, no se deben utilizar reactivos con grupos carbonilo electrofílicos débiles, aminas nucleófilas pobres y centros reactivos estéricamente impedidos, ya que estas propiedades no favorecen la reducción del carbonilo para formar una imina y aumentan la posibilidad de que se reduzcan otros grupos funcionales en su lugar. [3]
El cianoborohidruro de sodio es soluble en solventes hidroxílicos, estable en soluciones ácidas y tiene diferentes selectividades dependiendo del pH. [2] A valores de pH bajos, reduce eficientemente aldehídos y cetonas. [7] A medida que aumenta el pH, la tasa de reducción se hace más lenta y, en cambio, el intermediario imina se vuelve preferencial para la reducción. [7] Por esta razón, NaBH3CN es un agente reductor ideal para reacciones de aminación reductora directa en un solo recipiente que no aíslan el intermediario imina. [2]
Cuando se utiliza como agente reductor, el NaBH3CN puede liberar subproductos tóxicos como HCN y NaCN durante el procesamiento. [2]
Esta reacción está relacionada con la reacción de Eschweiler-Clarke , en la que las aminas se metilan a aminas terciarias, la reacción de Leuckart-Wallach , [8] o mediante otros métodos de alquilación de aminas como la reacción de Mannich y la reacción de Petasis .
Una reacción clásica es la reacción de Mignonac (1921) [9] que implica la reacción de una cetona con amoníaco sobre un catalizador de níquel, por ejemplo en una síntesis de 1-feniletilamina a partir de acetofenona : [10]
Además, existen muchos sistemas que catalizan la aminación reductora con un catalizador de hidrogenación . [11] Generalmente, se prefiere la catálisis a las reacciones estequiométricas para permitir que la reacción sea más eficiente, más económica en átomos y produzca menos desechos. [12] Este puede ser un sistema catalítico homogéneo o un sistema heterogéneo. [11] Estos sistemas proporcionan un método alternativo que es eficiente, requiere menos reactivos volátiles y es económico en términos redox. [11] [13] Además, este método se puede utilizar en la reducción de alcoholes , junto con aldehídos y cetonas para formar el producto amina . [11] Un ejemplo de un sistema catalítico heterogéneo es la aminación reductora de alcoholes utilizando el sistema catalizado por Ni. [11] [14]

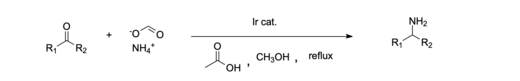
El níquel se utiliza comúnmente como catalizador para la aminación reductora debido a su abundancia y actividad catalítica relativamente buena. [11] [15] Un ejemplo de un sistema catalítico homogéneo es la aminación reductora de cetonas realizada con un catalizador de iridio . [16] Además, se ha demostrado que es eficaz utilizar un sistema catalizador de iridio (III) homogéneo para aminar reductoramente ácidos carboxílicos , lo que en el pasado ha sido más difícil que los aldehídos y las cetonas. [12] Los catalizadores homogéneos suelen ser los preferidos porque son más respetuosos con el medio ambiente y la economía en comparación con la mayoría de los sistemas heterogéneos. [11]
En la industria, las aminas terciarias como la trietilamina y la diisopropiletilamina se forman directamente a partir de cetonas con una mezcla gaseosa de amoníaco e hidrógeno y un catalizador adecuado.
La aminación reductora se utiliza comúnmente sobre otros métodos para introducir aminas en sustratos de alquilo, como las reacciones de tipo S N 2 con haluros , ya que se puede realizar en condiciones suaves y tiene una alta selectividad para los compuestos que contienen nitrógeno. [17] [18] La aminación reductora puede ocurrir secuencialmente en reacciones de un solo recipiente, lo que elimina la necesidad de purificaciones intermedias y reduce el desperdicio. [17] Algunas vías sintéticas de varios pasos se han reducido a un solo paso a través de la aminación reductora de un solo recipiente. [17] Esto lo convierte en un método muy atractivo para producir aminas en la química verde.
En bioquímica, las enzimas deshidrogenasas pueden catalizar la aminación reductora de α-cetoácidos y amoníaco para producir α -aminoácidos . La aminación reductora se utiliza predominantemente para la síntesis del aminoácido glutamato a partir de α-cetoglutarato, mientras que la bioquímica se basa en gran medida en la transaminación para introducir nitrógeno en los otros aminoácidos. [19] El uso de enzimas como catalizador es ventajoso porque los sitios activos de las enzimas a menudo son estereoespecíficos y tienen la capacidad de sintetizar selectivamente un cierto enantiómero . [20] Esto es útil en la industria farmacéutica, particularmente para el desarrollo de fármacos , porque los pares de enantiómeros pueden tener diferentes reactividades en el cuerpo. [1] [21] Además, los biocatalizadores enzimáticos a menudo son bastante selectivos en reactividad, por lo que se pueden usar en presencia de otros grupos funcionales, sin el uso de grupos protectores . [20] [22] Por ejemplo, una clase de enzimas llamadas imina reductasas , IRED, se pueden utilizar para catalizar la aminación reductiva asimétrica directa para formar aminas quirales. [1] [22]
En el drama aclamado por la crítica Breaking Bad , el personaje principal Walter White utiliza la reacción de aminación reductora para producir su metanfetamina de alta pureza , basándose en fenil-2-propanona y metilamina .