La desoxigenación de Barton-McCombie es una reacción orgánica en la que un grupo funcional hidroxi en un compuesto orgánico se reemplaza por un hidrógeno para dar un grupo alquilo . [1] [2] Lleva el nombre de los químicos británicos Sir Derek Harold Richard Barton y Stuart W. McCombie.

Esta reacción de desoxigenación es una sustitución radicalaria . En la descarboxilación de Barton relacionada, el reactivo es un ácido carboxílico .
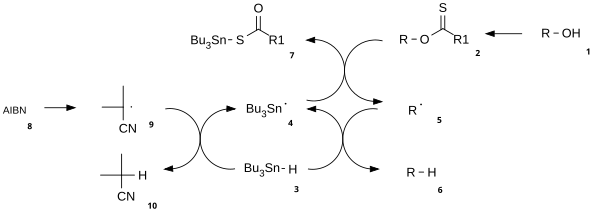
El mecanismo de reacción consiste en un paso de iniciación radical catalítico y un paso de propagación. [3] El alcohol ( 1 ) primero se convierte en un intermedio carbonotioilo reactivo tal como un tionoéster o xantato 2. El calentamiento de AIBN resulta en su escisión homolítica, generando dos radicales 2-cianoprop-2-ilo 9 , los cuales abstraen cada uno un hidrógeno del tributilestannano 3 para generar radicales tributilestannilo 4 e inactivo 10. El radical tributilestaño abstrae el grupo xantato de 2 por ataque de 4 en el átomo de azufre con escisión homolítica concurrente del enlace π CS. Esto deja un radical centrado en el carbono que forma un enlace π CO a través de la escisión homolítica del enlace σ RO, dando el radical alquilo 5 y el xantato de tributilestaño 7. El enlace de azufre y estaño en este compuesto es muy estable y proporciona la fuerza impulsora para esta reacción. El radical alquilo 5 luego abstrae un átomo de hidrógeno de una nueva molécula de tributilestannano generando el producto desoxigenado deseado ( 6 ) y una nueva especie radical lista para la propagación.
Las fracciones estabilizadoras de radicales cercanas pueden capturar el intermediario radical de la fisión del tionoéster, como en una síntesis total de azadiractina : [4]

Otros reactivos de tiocarbonilo pueden reemplazar al cloruro de tioacilo. En una variación, el reactivo es el imidazol 1,1'-tiocarbonildiimidazol (TCDI), por ejemplo, en la síntesis total de pallescensina B. [5] El TCDI es especialmente bueno para los alcoholes primarios porque no hay estabilización por resonancia del xantato; el par solitario de nitrógeno está involucrado en el sexteto aromático. [ cita requerida ]
La reacción también se aplica a los S -alquilxantatos. [6]
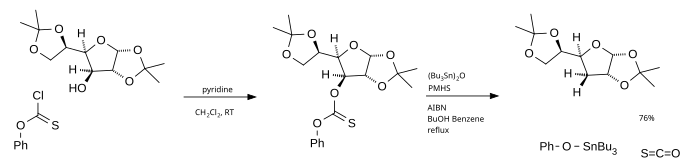
La principal desventaja de la desoxigenación por Barton-McCombie es el tributilestanano, un compuesto tóxico y costoso, cuyos productos finales son difíciles de eliminar de la mezcla de reacción. Una alternativa es el óxido de tributilestaño como fuente de radicales y el poli(metilhidruro de siloxano) (PMHS) como fuente de hidrógeno . [7]
Ambos roles se combinan en los trialquilboranos , que pueden abstraer los átomos de hidrógeno requeridos de los solventes próticos, la pared del reactor o incluso (en condiciones estrictamente anhidras) el propio borano. [6] Normalmente los reactivos son trimetilborano o trietilborano contaminados con pequeñas cantidades de agua. [8]
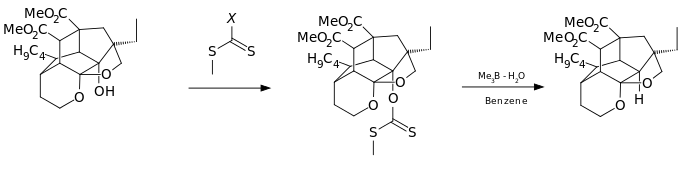
El ciclo catalítico comienza cuando el aire oxida el trialquilborano 3 al ácido borínico y al radical metilo 4. Este radical metila el xantato 2 , que se fragmenta en S-metil-S-metil ditiocarbonato 7 y el radical intermedio 5. 5 abstrae un hidrógeno del borano 3 para reformar 4 y producir el alcano 6 .
Los cálculos teóricos sugieren que la homólisis de OH en un complejo de borano-agua es endotérmica , pero la barrera de energía es comparable a la homólisis del tributilestannano y no del agua pura.