El neón es un elemento químico ; su símbolo es Ne y su número atómico es 10. Es el segundo gas noble de la tabla periódica. [14] El neón es un gas monoatómico incoloro, inodoro e inerte en condiciones estándar , con aproximadamente dos tercios de la densidad del aire.
El neón fue descubierto en 1898 junto con el criptón y el xenón , identificado como uno de los tres elementos inertes raros restantes en el aire seco después de la eliminación del nitrógeno , el oxígeno , el argón y el dióxido de carbono . Su descubrimiento estuvo marcado por el distintivo espectro de emisión rojo brillante que exhibía, lo que llevó a su reconocimiento inmediato como un nuevo elemento. El nombre neón se origina de la palabra griega νέον , una forma singular neutra de νέος ( neos ), que significa 'nuevo'. El neón es un gas químicamente inerte , los compuestos de neón existentes son principalmente moléculas iónicas o moléculas frágiles unidas por fuerzas de van der Waals .
La síntesis de la mayor parte del neón en el cosmos resultó de la fusión nuclear dentro de las estrellas de oxígeno y helio a través del proceso de captura alfa . A pesar de su abundante presencia en el universo y el Sistema Solar (ocupando el quinto lugar en abundancia cósmica después del hidrógeno, el helio, el oxígeno y el carbono), el neón es comparativamente escaso en la Tierra. Constituye alrededor de 18,2 ppm del volumen atmosférico de la Tierra y una fracción menor en la corteza terrestre. La alta volatilidad del neón y su incapacidad para formar compuestos que lo anclarían a los sólidos explican su presencia limitada en la Tierra y los planetas terrestres interiores . La alta volatilidad del neón facilitó su escape de los planetesimales bajo el calor del Sol naciente del Sistema Solar temprano.
Las aplicaciones notables del neón incluyen su uso en lámparas de neón de bajo voltaje , tubos de descarga de alto voltaje y letreros publicitarios de neón , donde emite un brillo rojizo-anaranjado distintivo. [15] [16] Esta misma línea de emisión roja es responsable de la luz roja característica de los láseres de helio-neón . Aunque el neón tiene algunas aplicaciones en tubos de plasma y como refrigerante, sus usos comerciales son relativamente limitados. Se obtiene principalmente a través de la destilación fraccionada de aire líquido , lo que lo hace significativamente más caro que el helio debido a que el aire es su única fuente.

El neón fue descubierto en 1898 por los químicos británicos Sir William Ramsay (1852-1916) y Morris Travers (1872-1961) en Londres . [11] El neón fue descubierto cuando Ramsay enfrió una muestra de aire hasta que se convirtió en líquido, luego calentó el líquido y capturó los gases a medida que se evaporaban. Los gases nitrógeno , oxígeno y argón habían sido identificados, pero los gases restantes fueron aislados aproximadamente en su orden de abundancia, en un período de seis semanas que comenzó a fines de mayo de 1898. El primer gas restante que se identificó fue el criptón ; el siguiente, después de que se había eliminado el criptón, fue un gas que emitía una luz roja brillante bajo descarga espectroscópica. Este gas, identificado en junio, fue llamado "neón", el análogo griego del latín novum ('nuevo') [17] sugerido por el hijo de Ramsay. El característico color rojo anaranjado brillante emitido por el neón gaseoso cuando se excita eléctricamente se notó de inmediato. Travers escribió más tarde: "el resplandor de la luz carmesí del tubo contaba su propia historia y era un espectáculo para reflexionar y no olvidar nunca". [18]
Junto con el neón se descubrió un segundo gas, que tenía aproximadamente la misma densidad que el argón pero un espectro diferente: Ramsay y Travers lo llamaron metargón . [19] [11] Sin embargo, el análisis espectroscópico posterior reveló que se trataba de argón contaminado con monóxido de carbono . Finalmente, el mismo equipo descubrió el xenón mediante el mismo proceso, en septiembre de 1898. [19]
La escasez del neón impidió su rápida aplicación para la iluminación, en la línea de los tubos Moore , que utilizaban nitrógeno y que se comercializaron a principios del siglo XX. Después de 1902, la empresa de Georges Claude, Air Liquide, produjo cantidades industriales de neón como subproducto de su negocio de licuefacción de aire. En diciembre de 1910, Claude demostró la iluminación de neón moderna basada en un tubo de neón sellado. Claude intentó brevemente vender tubos de neón para la iluminación doméstica interior, debido a su intensidad, pero el mercado fracasó porque los propietarios de viviendas se opusieron al color. En 1912, el socio de Claude comenzó a vender tubos de descarga de neón como llamativos carteles publicitarios y tuvo más éxito al instante. Los tubos de neón se introdujeron en los EE. UU. en 1923 con dos grandes carteles de neón comprados por un concesionario de automóviles Packard de Los Ángeles. El brillo y el llamativo color rojo hicieron que la publicidad de neón fuera completamente diferente de la competencia. [20] El intenso color y la vitalidad del neón se equiparaban a la sociedad estadounidense de la época, sugiriendo un "siglo de progreso" y transformando las ciudades en nuevos entornos sensacionales llenos de anuncios radiantes y "arquitectura electrográfica". [21] [22]
El neón jugó un papel en la comprensión básica de la naturaleza de los átomos en 1913, cuando JJ Thomson , como parte de su exploración de la composición de los rayos canal , canalizó corrientes de iones de neón a través de un campo magnético y eléctrico y midió la desviación de las corrientes con una placa fotográfica. Thomson observó dos parches separados de luz en la placa fotográfica (ver imagen), lo que sugirió dos parábolas de desviación diferentes. Thomson finalmente concluyó que algunos de los átomos en el gas neón tenían una masa mayor que el resto. Aunque Thomson no lo entendió en ese momento, este fue el primer descubrimiento de isótopos de átomos estables . El dispositivo de Thomson era una versión rudimentaria del instrumento que ahora llamamos espectrómetro de masas .

El neón tiene tres isótopos estables : 20 Ne (90,48%), 21 Ne (0,27%) y 22 Ne (9,25%). [13] El 21 Ne y el 22 Ne son en parte primordiales y en parte nucleogénicos (es decir, se forman por reacciones nucleares de otros nucleidos con neutrones u otras partículas del entorno) y sus variaciones en abundancia natural son bien conocidas. Por el contrario, no se sabe que el 20 Ne (el principal isótopo primordial formado en la nucleosíntesis estelar ) sea nucleogénico o radiogénico , excepto por la desintegración del oxígeno-20 , que se produce en casos muy raros de desintegración de cúmulos por el torio-228 . Por ello, las causas de la variación del 20 Ne en la Tierra han sido objeto de acalorados debates. [23] [24]
Las principales reacciones nucleares que generan isótopos nucleogénicos de neón comienzan a partir de 24 Mg y 25 Mg, que producen 21 Ne y 22 Ne respectivamente, después de la captura de neutrones y la emisión inmediata de una partícula alfa . Los neutrones que producen las reacciones se producen principalmente por reacciones de espalación secundaria de partículas alfa, derivadas a su vez de cadenas de desintegración de la serie del uranio . El resultado neto arroja una tendencia hacia proporciones más bajas de 20 Ne/ 22 Ne y más altas de 21 Ne/ 22 Ne observadas en rocas ricas en uranio como los granitos . [24]
Además, el análisis isotópico de rocas terrestres expuestas ha demostrado la producción cosmogénica (rayos cósmicos) de 21 Ne. Este isótopo se genera por reacciones de espalación en magnesio , sodio , silicio y aluminio . Al analizar los tres isótopos, el componente cosmogénico se puede resolver a partir del neón magmático y el neón nucleogénico. Esto sugiere que el neón será una herramienta útil para determinar las edades de exposición cósmica de rocas superficiales y meteoritos . [25]
El neón presente en el viento solar contiene una mayor proporción de 20Ne que las fuentes nucleogénicas y cosmogénicas. [24] El contenido de neón observado en muestras de gases volcánicos y diamantes también está enriquecido en 20Ne , lo que sugiere un origen primordial, posiblemente solar. [26]
El neón es el segundo gas noble más ligero, después del helio . Al igual que otros gases nobles, el neón es incoloro e inodoro. Brilla de color naranja rojizo en un tubo de descarga de vacío . Tiene más de 40 veces la capacidad de refrigeración (por unidad de volumen) del helio líquido y tres veces la del hidrógeno líquido . [3] En la mayoría de las aplicaciones es un refrigerante menos costoso que el helio. [27] [28] A pesar de que el helio supera al neón en términos de energía de ionización , se teoriza que es el menos reactivo de todos los elementos, incluso menos que el primero. [29]

El plasma de neón tiene la descarga de luz más intensa a voltajes y corrientes normales de todos los gases nobles. El color promedio de esta luz para el ojo humano es rojo anaranjado debido a muchas líneas en este rango; también contiene una línea verde intensa, que está oculta, a menos que los componentes visuales se dispersen con un espectroscopio. [30]
Los isótopos estables del neón se producen en las estrellas. El isótopo más abundante del neón, el 20 Ne (90,48 %), se crea mediante la fusión nuclear de carbono y carbono en el proceso de combustión de carbono de la nucleosíntesis estelar . Esto requiere temperaturas superiores a los 500 megakelvins , que se producen en los núcleos de estrellas de más de 8 masas solares. [31] [32]
El neón es abundante a escala universal; es el quinto elemento químico más abundante en el universo por masa, después del hidrógeno, el helio, el oxígeno y el carbono (ver elemento químico ). [33] Su relativa rareza en la Tierra, como la del helio, se debe a su relativa ligereza, alta presión de vapor a temperaturas muy bajas e inercia química, todas propiedades que tienden a evitar que quede atrapado en las nubes de gas y polvo que se condensan y que forman los planetas sólidos más pequeños y cálidos como la Tierra. El neón es monoatómico, lo que lo hace más ligero que las moléculas de nitrógeno y oxígeno diatómicos que forman la mayor parte de la atmósfera terrestre; un globo lleno de neón se elevará en el aire, aunque más lentamente que un globo de helio. [34]
La abundancia de neón en el universo es de aproximadamente 1 parte en 750 en masa; en el Sol y presumiblemente en su nebulosa proto-sistema solar, de aproximadamente 1 parte en 600. [ cita requerida ] La sonda de entrada atmosférica de la nave espacial Galileo descubrió que en la atmósfera superior de Júpiter, la abundancia de neón se reduce (agota) en aproximadamente un factor de 10, a un nivel de 1 parte en 6000 en masa. Esto puede indicar que los planetesimales de hielo que trajeron el neón a Júpiter desde el sistema solar exterior se formaron en una región que era demasiado cálida para retener el componente atmosférico de neón (las abundancias de gases inertes más pesados en Júpiter son varias veces mayores que las que se encuentran en el Sol), [35] o que el neón está secuestrado selectivamente en el interior del planeta. [36]
El neón representa 1 parte en 55.000 en la atmósfera terrestre , o 18,2 ppm en volumen (esto es aproximadamente lo mismo que la molécula o fracción molar), o 1 parte en 79.000 de aire en masa. Representa una fracción más pequeña en la corteza. Se produce industrialmente mediante destilación fraccionada criogénica de aire licuado. [3]
El 17 de agosto de 2015, basándose en estudios realizados con la nave espacial Lunar Atmosphere and Dust Environment Explorer (LADEE), los científicos de la NASA informaron sobre la detección de neón en la exosfera de la luna . [37]
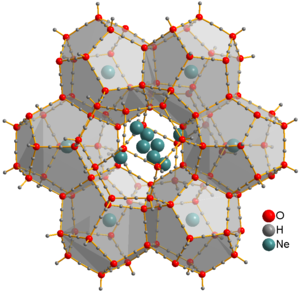
El neón es el primer gas noble del bloque p y el primer elemento con un verdadero octeto de electrones. Es inerte : como es el caso de su análogo más ligero, el helio , no se han identificado moléculas neutras fuertemente unidas que contengan neón. Un ejemplo de compuesto de neón es Cr(CO) 5 Ne, que contiene un enlace Ne-Cr muy débil. [39] Los iones [Ne Ar ] + , [Ne H ] + y [HeNe] + se han observado a partir de estudios ópticos y espectrométricos de masas . [3] El hidrato de clatrato de neón sólido se produjo a partir de hielo de agua y gas neón a presiones de 350–480 MPa y temperaturas de aproximadamente -30 °C. [40] Los átomos de Ne no están unidos al agua y pueden moverse libremente a través de este material. Se pueden extraer colocando el clatrato en una cámara de vacío durante varios días, lo que produce hielo XVI , la forma cristalina menos densa del agua. [38]
La conocida escala de electronegatividad de Pauling se basa en las energías de los enlaces químicos, pero obviamente dichos valores no se han medido para el helio y el neón inertes. La escala de electronegatividad de Allen , que se basa únicamente en energías atómicas (medibles), identifica al neón como el elemento más electronegativo, seguido de cerca por el flúor y el helio. [41]
La temperatura del punto triple del neón (24,5561 K) es un punto fijo definitorio en la Escala Internacional de Temperatura de 1990. [ 42]
El neón se produce a partir del aire en plantas criogénicas de separación de aire . Una mezcla en fase gaseosa compuesta principalmente por nitrógeno, neón, helio e hidrógeno [43] se extrae del condensador principal en la parte superior de la columna de separación de aire a alta presión y se alimenta a la parte inferior de una columna lateral para la rectificación del neón. [44] Luego se puede purificar aún más a partir del helio poniéndolo en contacto con carbón activado. El hidrógeno se purifica a partir del neón añadiendo oxígeno, de modo que se forma agua y se condensa. [43] Se puede producir una libra de neón puro a partir del procesamiento de 88.000 libras de la mezcla en fase gaseosa. [43]
Antes de la escalada de la guerra con Rusia en 2022, alrededor del 70% del suministro mundial de neón se producía en Ucrania [45] como subproducto de la producción de acero en Rusia . [46] A partir de 2020 [actualizar], la empresa Iceblick, con plantas en Odesa y Moscú , suministra el 65% de la producción mundial de neón, así como el 15% del criptón y el xenón . [47] [48]
Los precios mundiales del neón aumentaron alrededor de un 600% después de la anexión rusa de Crimea en 2014 , [49] lo que impulsó a algunos fabricantes de chips a comenzar a alejarse de los proveedores rusos y ucranianos [50] y acercarse a los proveedores de China . [48] La invasión rusa de Ucrania en 2022 también cerró dos empresas en Ucrania que producían aproximadamente la mitad del suministro global: Cryoin Engineering ( ucraniano : Кріоін Інжинірінг ) e Inhaz ( ucraniano : ІНГАЗ ), ubicadas en Odesa y Mariupol , respectivamente. [49] Se predijo que el cierre agravaría la escasez de chips COVID-19 , [48] [47] lo que puede trasladar aún más la producción de neón a China. [50]
.jpg/440px-FLORIST_(neon_sign).jpg)
Se utilizan habitualmente dos tipos de iluminación de neón muy diferentes . Las lámparas de neón son generalmente diminutas, y la mayoría funcionan entre 100 y 250 voltios . [51] Se han utilizado ampliamente como indicadores de encendido y en equipos de prueba de circuitos, pero los diodos emisores de luz (LED) dominan ahora en esas aplicaciones. Estos sencillos dispositivos de neón fueron los precursores de las pantallas de plasma y las pantallas de televisión de plasma . [52] [53] Los letreros de neón suelen funcionar a voltajes mucho más altos (2-15 kilovoltios ) y los tubos luminosos suelen tener metros de largo. [54] Los tubos de vidrio a menudo se moldean en formas y letras para señalización, así como para aplicaciones arquitectónicas y artísticas.
En los letreros de neón , el neón produce una luz naranja rojiza brillante inconfundible cuando la corriente eléctrica pasa a través de él a baja presión. [55] Aunque las luces de tubo con otros colores a menudo se denominan "neón", utilizan diferentes gases nobles o colores variados de iluminación fluorescente , por ejemplo, el argón produce un tono lavanda o azul. [56] A partir de 2012, hay más de cien colores disponibles. [57]
El neón se utiliza en tubos de vacío , indicadores de alto voltaje, pararrayos , tubos de medición de ondas , tubos de televisión y láseres de helio-neón . Las mezclas de gases que incluyen neón de alta pureza se utilizan en láseres para fotolitografía en la fabricación de dispositivos semiconductores . [49]
El neón licuado se utiliza comercialmente como refrigerante criogénico en aplicaciones que no requieren el rango de temperatura más bajo que se puede alcanzar con la refrigeración más extrema con helio líquido .
están estrechamente relacionadas con la sencilla lámpara de neón.