El ácido N -acetilglutámico (también denominado N -acetilglutamato , abreviado NAG , fórmula química C 7 H 11 NO 5 ) [2] se biosintetiza a partir de glutamato y acetilornitina por la ornitina acetiltransferasa, y a partir de ácido glutámico y acetil-CoA por la enzima N -acetilglutamato sintasa . La reacción inversa, la hidrólisis del grupo acetilo, es catalizada por una hidrolasa específica . Es el primer intermediario involucrado en la biosíntesis de arginina en procariotas y eucariotas simples y un regulador en el proceso conocido como el ciclo de la urea que convierte el amoníaco tóxico en urea para su excreción del cuerpo en vertebrados.
El ácido N -acetilglutámico es un metabolito extracelular aislado del procariota Rhizobium trifolii que se caracterizó utilizando muchas técnicas de determinación de estructura, como espectroscopia de resonancia magnética nuclear de protones ( 1H RMN), espectroscopia infrarroja por transformada de Fourier y cromatografía de gases-espectrometría de masas .
En Rhizobium , la acumulación extracelular de ácido N -acetilglutámico se debe al metabolismo que involucra a los genes del factor nod en un plásmido simbiótico . Cuando los factores nod están mutados, se produce menos ácido N -acetilglutámico. [3]
En procariotas y eucariotas simples, el ácido N -acetilglutámico puede ser producido por la N -acetilglutamato sintasa (NAGS) o la ornitina acetiltransferasa (OAT).
La OAT sintetiza ácido N -acetilglutámico a partir de glutamato y acetilornitina y es el método de elección para la producción en procariotas que tienen la capacidad de sintetizar el compuesto ornitina . [4]
La N -acetilglutamato sintasa es una enzima que actúa como reponedora de ácido N -acetilglutámico para complementar cualquier ácido N -acetilglutámico perdido por la célula a través de la mitosis o degradación. La NAGS sintetiza ácido N -acetilglutámico catalizando la adición de un grupo acetilo de la acetil-coenzima A al glutamato . En procariotas con producción no cíclica de ornitina, la NAGS es el único método de síntesis de ácido N -acetilglutámico y es inhibida por la arginina. [4] Se cree que la acetilación del glutamato evita que el glutamato sea utilizado por la biosíntesis de prolina . [5]
A diferencia de los procariotas, la NAGS en los mamíferos se potencia con arginina, junto con protaminas . Se inhibe con ácido N -acetilglutámico y sus análogos (otros compuestos N -acetilados). [4]
El cerebro también contiene ácido N -acetilglutámico en cantidades mínimas, pero no se ha detectado expresión de NAGS. Esto sugiere que el ácido N -acetilglutámico es producido por otra enzima del cerebro que aún no se ha determinado. [4]
En vértebras y mamíferos, el ácido N -acetilglutámico es la molécula activadora alostérica de la carbamil fosfato sintetasa mitocondrial I (CPSI), que es la primera enzima en el ciclo de la urea. [6] Activa la producción del primer intermediario del ciclo de la urea, el carbamil fosfato . La CPSI está inactiva cuando el ácido N -acetilglutámico no está presente. En el hígado y el intestino delgado, la CPSI dependiente del ácido N -acetilglutámico produce citrulina , el segundo intermediario en el ciclo de la urea. La distribución del ácido N -acetilglutámico en las células hepáticas es más alta en las mitocondrias con un 56% de la disponibilidad total de ácido N -acetilglutámico, un 24% en el núcleo y el 20% restante en el citosol. La aminoacilasa I en las células del hígado y los riñones degrada el ácido N -acetilglutámico a glutamato y acetato. [7] Por el contrario, el ácido N -acetilglutámico no es el cofactor alostérico de la carbamil fosfato sintetasa que se encuentra en el citoplasma y que participa en la síntesis de pirimidina . [8]
Las concentraciones de ácido N -acetilglutámico aumentan cuando aumenta el consumo de proteínas debido a la acumulación de amoníaco que debe secretarse a través del ciclo de la urea, lo que respalda el papel del ácido N -acetilglutámico como cofactor de la CPSI. Además, el ácido N -acetilglutámico se puede encontrar en muchos alimentos de consumo común, como la soja, el maíz y el café, y el cacao en polvo contiene una concentración notablemente alta. [9]
La deficiencia de ácido N -acetilglutámico en humanos es un trastorno autosómico recesivo que produce un bloqueo de la producción de urea, lo que en última instancia aumenta la concentración de amoníaco en la sangre ( hiperamonemia ). La deficiencia puede ser causada por defectos en el gen codificante de NAGS o por deficiencias en los precursores esenciales para la síntesis. [4]
El ácido N -acetilglutámico es el segundo intermediario en la vía de producción de arginina en Escherichia coli y se produce a través de NAGS. [5] En esta vía, la quinasa del ácido N -acetilglutámico (NAGK) cataliza la fosforilación del grupo carboxilo gamma (tercero) del ácido N -acetilglutámico utilizando el fosfato producido por hidrólisis del trifosfato de adenosina (ATP). [10]
Rhizobium puede formar una relación simbiótica con las raíces de las plántulas de trébol blanco y formar colonias. El ácido N -acetilglutámico extracelular producido por estas bacterias tiene tres efectos morfológicos en las raíces de las plántulas de trébol blanco: ramificación de los pelos radiculares, hinchazón de las puntas de las raíces y aumento en el número de divisiones celulares en células indiferenciadas que se encuentran en la capa celular más externa de la raíz. Esto sugiere que el ácido N -acetilglutámico está involucrado en la estimulación de la mitosis. Se observaron los mismos efectos en el trébol fresa , pero no en las legumbres . Los efectos del ácido N -acetilglutámico en las especies de trébol fueron más potentes que los efectos de la glutamina , el glutamato, la arginina o el amoníaco . [4]

El ácido N -acetilglutámico está compuesto por dos grupos de ácido carboxílico y un grupo amida que sobresale del segundo carbono. La estructura del ácido N -acetilglutámico a pH fisiológico (7,4) tiene todos los grupos carboxilo desprotonados .
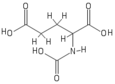

La estructura molecular del ácido N -acetilglutámico se determinó mediante espectroscopia de RMN de protones . [3] La RMN de protones revela la presencia y la ubicación del grupo funcional de los protones en función de los desplazamientos químicos registrados en el espectro. [11]
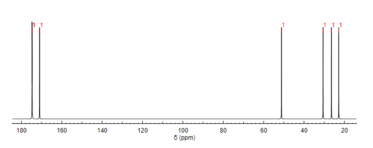
Al igual que la RMN de protones, la espectroscopia de RMN de carbono-13 ( 13 C) es un método utilizado en la determinación de la estructura molecular. La RMN de 13 C revela los tipos de carbonos presentes en una molécula en función de los desplazamientos químicos que corresponden a ciertos grupos funcionales. El ácido N -acetilglutámico exhibe carbonos carbonílicos de forma más distintiva debido a los tres sustituyentes que contienen carbonilo. [12]