La potencia celular es la capacidad de una célula para diferenciarse en otros tipos de células. [1] [2] Cuantos más tipos de células pueda diferenciarse una célula, mayor será su potencia. La potencia también se describe como el potencial de activación genética dentro de una célula, que como un continuo, comienza con la totipotencia para designar a una célula con el mayor potencial de diferenciación, pluripotencia , multipotencia , oligopotencia y, finalmente, unipotencia .

La totipotencia (del latín totipotentia , lit. 'capacidad para todas [las cosas]') es la capacidad de una sola célula de dividirse y producir todas las células diferenciadas en un organismo . Las esporas y los cigotos son ejemplos de células totipotentes. [3] En el espectro de la potencia celular, la totipotencia representa la célula con el mayor potencial de diferenciación , pudiendo diferenciarse en cualquier célula embrionaria , así como en cualquier célula de tejido extraembrionario . Por el contrario, las células pluripotentes solo pueden diferenciarse en células embrionarias. [4] [5]
Una célula completamente diferenciada puede volver a un estado de totipotencia. [6] La conversión a totipotencia es compleja y no se comprende del todo. En 2011, una investigación reveló que las células pueden diferenciarse no en una célula completamente totipotente, sino en una "variación celular compleja" de totipotencia. [7]
El modelo de desarrollo humano se puede utilizar para describir cómo surgen las células totipotentes. [8] El desarrollo humano comienza cuando un espermatozoide fertiliza un óvulo y el óvulo fertilizado resultante crea una sola célula totipotente, un cigoto . [9] En las primeras horas después de la fertilización, este cigoto se divide en células totipotentes idénticas, que luego pueden desarrollarse en cualquiera de las tres capas germinales de un humano ( endodermo , mesodermo o ectodermo ), o en células de la placenta ( citotrofoblasto o sinciciotrofoblasto ). Después de alcanzar una etapa de 16 células, las células totipotentes de la mórula se diferencian en células que eventualmente se convertirán en la masa celular interna del blastocisto o en los trofoblastos externos . Aproximadamente cuatro días después de la fertilización y después de varios ciclos de división celular, estas células totipotentes comienzan a especializarse. La masa celular interna, la fuente de las células madre embrionarias , se vuelve pluripotente.
Las investigaciones sobre Caenorhabditis elegans sugieren que múltiples mecanismos, incluida la regulación del ARN, pueden desempeñar un papel en el mantenimiento de la totipotencia en diferentes etapas del desarrollo en algunas especies. [10] Los trabajos con pez cebra y mamíferos sugieren una interacción adicional entre el microARN y las proteínas de unión al ARN (RBP) en la determinación de las diferencias en el desarrollo. [11]
En las células germinales primordiales del ratón , la reprogramación de todo el genoma que conduce a la totipotencia implica el borrado de las huellas epigenéticas . La reprogramación se ve facilitada por la desmetilación activa del ADN que implica la vía enzimática de reparación por escisión de bases del ADN. [12] Esta vía implica el borrado de la metilación de CpG (5mC) en las células germinales primordiales a través de la conversión inicial de 5mC a 5-hidroximetilcitosina (5hmC), una reacción impulsada por altos niveles de las enzimas dioxigenasas diez-once TET-1 y TET-2 . [13]
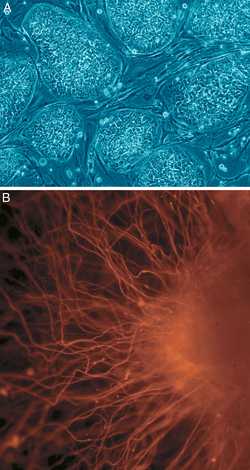
En biología celular, pluripotencia (del latín pluripotentia , literalmente 'capacidad para muchas [cosas]') [14] se refiere a una célula madre que tiene el potencial de diferenciarse en cualquiera de las tres capas germinales : endodermo (intestino, pulmones e hígado), mesodermo (músculo, esqueleto, vasos sanguíneos, urogenital, dermis) o ectodermo (nervioso, sensorial, epidermis), pero no en tejidos extraembrionarios como la placenta o el saco vitelino. [15]
Las células madre pluripotentes inducidas, comúnmente abreviadas como células iPS o iPSC, son un tipo de célula madre pluripotente derivada artificialmente de una célula no pluripotente, típicamente una célula somática adulta , al inducir una expresión "forzada" de ciertos genes y factores de transcripción . [16] Estos factores de transcripción juegan un papel clave en la determinación del estado de estas células y también resaltan el hecho de que estas células somáticas preservan la misma información genética que las células embrionarias tempranas. [17] La capacidad de inducir células a un estado pluripotente fue inicialmente pionera en 2006 usando fibroblastos de ratón y cuatro factores de transcripción, Oct4 , Sox2 , Klf4 y c- Myc ; [18] esta técnica, llamada reprogramación , más tarde le valió a Shinya Yamanaka y John Gurdon el Premio Nobel de Fisiología o Medicina. [19] En 2007, se logró inducir con éxito iPSC humanas derivadas de fibroblastos dérmicos humanos utilizando métodos similares a los utilizados para la inducción de células de ratón. [20] Estas células inducidas presentan rasgos similares a los de las células madre embrionarias (CME) pero no requieren el uso de embriones. Algunas de las similitudes entre las CME y las iPSC incluyen pluripotencia, morfología , capacidad de autorrenovación (un rasgo que implica que pueden dividirse y replicarse indefinidamente) y expresión genética . [21]
También se cree que los factores epigenéticos intervienen en la reprogramación de las células somáticas para inducir la pluripotencia. Se ha planteado la teoría de que ciertos factores epigenéticos podrían funcionar para eliminar las marcas epigenéticas somáticas originales con el fin de adquirir las nuevas marcas epigenéticas que forman parte del proceso de alcanzar un estado pluripotente. La cromatina también se reorganiza en las iPSC y se vuelve similar a la que se encuentra en las células madre embrionarias, en el sentido de que está menos condensada y, por lo tanto, es más accesible. Las modificaciones de la eucromatina también son comunes, lo que también es coherente con el estado de la eucromatina que se encuentra en las células madre embrionarias. [21]
Debido a su gran similitud con las células madre embrionarias, las comunidades médicas y de investigación están interesadas en las iPSC. Las iPSC podrían tener potencialmente las mismas implicaciones y aplicaciones terapéuticas que las células madre embrionarias, pero sin el controvertido uso de embriones en el proceso, un tema de gran debate bioético. La pluripotencia inducida de células somáticas en células iPS indiferenciadas fue originalmente aclamada como el fin del controvertido uso de células madre embrionarias . Sin embargo, se descubrió que las iPSC eran potencialmente tumorigénicas y, a pesar de los avances, [16] nunca fueron aprobadas para la investigación en etapa clínica en los Estados Unidos hasta hace poco. Actualmente, las células progenitoras dopaminérgicas derivadas de iPSC autólogas se utilizan en ensayos para tratar la enfermedad de Parkinson. [22] También se han encontrado inconvenientes como bajas tasas de replicación y senescencia temprana al fabricar iPSC, [23] lo que dificulta su uso como reemplazos de las células madre embrionarias.
La expresión somática de factores de transcripción combinados puede inducir directamente otros destinos celulares somáticos definidos ( transdiferenciación ); los investigadores identificaron tres factores de transcripción específicos del linaje neuronal que podrían convertir directamente fibroblastos de ratón (células del tejido conectivo) en neuronas completamente funcionales . [24] Este resultado desafía la naturaleza terminal de la diferenciación celular y la integridad del compromiso de linaje; e implica que con las herramientas adecuadas, todas las células son totipotentes y pueden formar todo tipo de tejido.
Algunos de los posibles usos médicos y terapéuticos de las iPSC derivadas de pacientes incluyen su uso en trasplantes de células y tejidos sin el riesgo de rechazo que se encuentra comúnmente. Las iPSC pueden reemplazar potencialmente a los modelos animales inadecuados, así como a los modelos in vitro utilizados para la investigación de enfermedades. [25]

Los hallazgos con respecto a los epiblastos antes y después de la implantación han producido propuestas para clasificar la pluripotencia en dos estados: "ingenuo" y "preparado", que representan el epiblasto anterior y posterior a la implantación, respectivamente. [26] El continuo ingenuo a preparado está controlado por la reducción de la dimerización de Sox2/Oct4 en los elementos de ADN SoxOct que controlan la pluripotencia ingenua. [27] Las células madre pluripotentes preparadas de diferentes especies podrían restablecerse al estado ingenuo utilizando un cóctel que contenga Klf4 y Sox2 o "super-Sox", un factor de transcripción quimérico con capacidad mejorada para dimerizarse con Oct4. [27]
Las células madre de base que se utilizan comúnmente en la ciencia y que se denominan células madre embrionarias (CME) se derivan de un epiblasto preimplantacional; dicho epiblasto es capaz de generar el feto completo, y una célula del epiblasto puede contribuir a todos los linajes celulares si se inyecta en otro blastocisto. Por otro lado, se pueden observar varias diferencias marcadas entre los epiblastos preimplantacionales y postimplantacionales, como su diferencia en la morfología, en la que el epiblasto después de la implantación cambia su morfología a una forma similar a una copa llamada "cilindro de óvulo", así como la alteración cromosómica en la que uno de los cromosomas X se inactiva aleatoriamente en la etapa temprana del cilindro de óvulo, conocida como inactivación de X. [28] Durante este desarrollo, las células del epiblasto del cilindro de óvulo son el objetivo sistemático de los factores de crecimiento de fibroblastos , la señalización de Wnt y otros factores inductivos a través del saco vitelino circundante y el tejido del trofoblasto, [29] de modo que se vuelven instructivamente específicas de acuerdo con la organización espacial. [30]
Otra diferencia importante es que las células madre del epiblasto post-implantación no pueden contribuir a las quimeras de blastocisto , [31] lo que las distingue de otras células madre pluripotentes conocidas. Las líneas celulares derivadas de dichos epiblastos post-implantación se denominan células madre derivadas del epiblasto , que se derivaron por primera vez en el laboratorio en 2007. Tanto las ESC como las EpiSC se derivan de epiblastos pero en diferentes fases de desarrollo. La pluripotencia sigue intacta en el epiblasto post-implantación, como lo demuestra la expresión conservada de Nanog , Fut4 y Oct-4 en las EpiSC, [32] hasta la somitogénesis y puede revertirse a mitad de camino a través de la expresión inducida de Oct-4 . [33]
_Ranunculus_asiaticus_-_example_of_Totipotency.jpg/440px-(MHNT)_Ranunculus_asiaticus_-_example_of_Totipotency.jpg)
Se ha observado pluripotencia no inducida en cultivos de tejido de meristemo de raíz, especialmente por Kareem et al 2015, Kim et al 2018 y Rosspopoff et al 2017. Esta pluripotencia está regulada por varios reguladores, incluidos PLETHORA 1 y PLETHORA 2 ; y PLETHORA 3 , PLETHORA 5 y PLETHORA 7 , cuya expresión, según descubrió Kareem, estaba provocada por auxinas . (Estos también se conocen como PLT1, PLT2, PLT3, PLT5, PLT7 y se expresan por genes con los mismos nombres). A partir de 2019 [actualizar], se espera que esto abra futuras investigaciones sobre la pluripotencia en tejidos de raíz. [34]

La multipotencia es cuando las células progenitoras tienen el potencial de activación genética para diferenciarse en tipos de células discretos. Por ejemplo, una célula madre hematopoyética, y este tipo de célula puede diferenciarse en varios tipos de células sanguíneas como linfocitos , monocitos , neutrófilos , etc., pero aún es ambiguo si las HSC poseen la capacidad de diferenciarse en células cerebrales , células óseas u otros tipos de células no sanguíneas. [ cita requerida ]
Las investigaciones relacionadas con las células multipotentes sugieren que estas células pueden ser capaces de convertirse en tipos de células no relacionadas. En otro caso, las células madre de la sangre del cordón umbilical humano se convirtieron en neuronas humanas. [35] También existen investigaciones sobre la conversión de células multipotentes en células pluripotentes. [36]
Las células multipotentes se encuentran en muchos tipos de células humanas, pero no en todos. Se han encontrado células multipotentes en la sangre del cordón umbilical , [37] el tejido adiposo, [38] las células cardíacas, [39] la médula ósea y las células madre mesenquimales (MSC), que se encuentran en el tercer molar . [40]
Las células madre mesenquimales pueden resultar una fuente valiosa de células madre a partir de molares de 8 a 10 años de edad, antes de la calcificación dental adulta. Las células madre mesenquimales pueden diferenciarse en osteoblastos, condrocitos y adipocitos. [41]
En biología, la oligopotencia es la capacidad de las células progenitoras de diferenciarse en unos pocos tipos de células . Es un grado de potencia . Ejemplos de células madre oligopotentes son las células madre linfoides o mieloides. [2] Una célula linfoide específicamente, puede dar lugar a varias células sanguíneas como las células B y T, sin embargo, no a un tipo de célula sanguínea diferente como un glóbulo rojo. [42] Ejemplos de células progenitoras son las células madre vasculares que tienen la capacidad de convertirse tanto en células endoteliales como en células de músculo liso.
En biología celular , una célula unipotente es el concepto de que una célula madre tiene la capacidad de diferenciarse en un solo tipo de célula. [43] Actualmente no está claro si existen verdaderas células madre unipotentes. Los hepatoblastos, que se diferencian en hepatocitos (que constituyen la mayor parte del hígado ) o colangiocitos (células epiteliales del conducto biliar), son bipotentes. [44] Un sinónimo cercano para célula unipotente es célula precursora .