
La química del organoaluminio es el estudio de los compuestos que contienen enlaces entre el carbono y el aluminio . Es uno de los temas principales dentro de la química organometálica . [1] [2] Compuestos de organoaluminio ilustrativos son el dímero trimetilaluminio , el monómero triisobutilaluminio y el compuesto de titanio-aluminio llamado reactivo de Tebbe . El comportamiento de los compuestos de organoaluminio puede entenderse en términos de la polaridad del enlace C-Al y la alta acidez de Lewis de las tres especies coordinadas. Industrialmente, estos compuestos se utilizan principalmente para la producción de poliolefinas .
El primer compuesto organoaluminio (C 2 H 5 ) 3 Al 2 I 3 se descubrió en 1859. [3] Sin embargo, los compuestos organoaluminio fueron poco conocidos hasta la década de 1950, cuando Karl Ziegler y sus colegas descubrieron la síntesis directa de compuestos de trialquilaluminio y aplicaron estos compuestos. a la polimerización catalítica de olefinas . Esta línea de investigación resultó finalmente en el Premio Nobel a Ziegler.
Los compuestos de organoaluminio generalmente presentan centros de Al de tres y cuatro coordenadas, aunque se observan números de coordinación más altos con ligandos inorgánicos como el fluoruro . De acuerdo con las tendencias habituales, el Al de cuatro coordenadas prefiere ser tetraédrico. A diferencia del boro, el aluminio es un átomo más grande y acomoda fácilmente cuatro ligandos de carbono. Por tanto, los compuestos de triorganoaluminio suelen ser diméricos con un par de ligandos alquilo puente , por ejemplo, Al 2 (C 2 H 5 ) 4 (μ-C 2 H 5 ) 2 . Así, a pesar de su nombre común de trietilaluminio, este compuesto contiene dos centros de aluminio y seis grupos etilo . Cuando el compuesto de organoaluminio contiene hidruro o haluro , estos ligandos más pequeños tienden a ocupar los sitios de puente. Se producen tres coordinaciones cuando los grupos R son voluminosos, por ejemplo, Al(Mes) 3 (Mes = 2,4,6-Me 3 C 6 H 2 o mesitilo ) o isobutilo. [4]

Los dímeros de trialquilaluminio a menudo participan en equilibrios dinámicos, lo que da como resultado el intercambio de ligandos terminales y puente, así como el intercambio de ligandos entre dímeros. Incluso en disolventes no coordinantes , el intercambio Al-Me es rápido, como lo confirma la espectroscopia de RMN de protones . Por ejemplo, a -25 °C el espectro de RMN 1 H de Me 6 Al 2 comprende dos señales en una proporción de 1:2, como se esperaba de la estructura de estado sólido. A 20 °C, solo se observa una señal porque el intercambio de grupos metilo terminales y puente es demasiado rápido para resolverse mediante RMN. [5] La alta acidez de Lewis de las especies monoméricas está relacionada con el tamaño del centro de Al(III) y su tendencia a alcanzar una configuración de octeto .
El primer compuesto de organoaluminio con un enlace Al-Al se informó en 1988 como (((Me 3 Si) 2 CH) 2 Al) 2 (un dialano). Normalmente se preparan reducción de los cloruros de dialquilaluminio por potasio metálico: [6]
Otro grupo notable de alanos son los tetraalanos que contienen cuatro centros de Al(I). Estos compuestos adoptan un núcleo de tetraedrano , como lo ilustran ( Cp* Al) 4 y ((Me 3 Si 3 C)Al) 4 . El grupo [Al 12 ( i-Bu ) 12 ] 2− se obtuvo de investigaciones relacionadas sobre la reducción de compuestos de organoaluminio. Este dianión adopta una estructura icosaédrica que recuerda al dodecaborato ([B 12 H 12 ] 2− ). Su estado de oxidación formal es menor que uno.
Industrialmente, los alquilos de aluminio simples del tipo Al 2 R 6 (R = Me, Et) se preparan en un proceso de dos pasos que comienza con la alquilación del polvo de aluminio:
La reacción se asemeja a la síntesis de los reactivos de Grignard . El producto, (CH 3 CH 2 ) 3 Al 2 Cl 3 , se llama sesquicloruro de etilaluminio . El término sesquicloruro se refiere al hecho de que, en promedio, la relación Cl:Al es 1,5. Estos sesquicloruros se pueden convertir en derivados de triorganoaluminio mediante reducción:
Este método se utiliza para la producción de trimetilaluminio y trietilaluminio . [7]
La reacción global para la producción de estos compuestos simples de alquilaluminio es, por tanto, la siguiente:
El polvo de aluminio reacciona directamente con ciertos alquenos terminales en presencia de hidrógeno. El proceso consta de dos pasos, el primero produce hidruros de dialquilaluminio. Estas reacciones suelen realizarse a temperaturas elevadas y requieren activación mediante reactivos de trialquilaluminio:
Para los grupos R no voluminosos, los hidruros de organoaluminio suelen ser triméricos. En un paso posterior, estos hidruros se tratan con más alqueno para efectuar la hidroaluminación:
El hidruro de diisobutilaluminio , que es dimérico, se prepara mediante eliminación de hidruro del triisobutilaluminio:
Los compuestos de organoaluminio pueden reaccionar con alquenos y alquinos, lo que resulta en la adición neta de un grupo organilo y el fragmento de metal a través del enlace múltiple (carboaluminación). Este proceso puede desarrollarse de forma puramente térmica o en presencia de un catalizador de metal de transición. Para el proceso no catalizado, la monoadición sólo es posible cuando se sustituye el alqueno. Para el etileno, la carboaluminación conduce a una distribución de Poisson de especies de alquilaluminio superiores. La reacción es regioselectiva para 1-alquenos . [8] La llamada reacción ZACA , reportada por primera vez por Ei-ichi Negishi, es un ejemplo de carboaluminación asimétrica de alquenos catalizada por un catalizador quiral de circonoceno. [9]
La metilaluminación de alquinos en presencia de Cp 2 ZrCl 2 [10] [11] se emplea para la síntesis de fragmentos de olefinas trisustituidas estereodefinidas, una subestructura común en productos naturales de terpenos y policétidos. La síntesis de ( E )-4-yodo-3-metilbut-3-en-1-ol [12] que se muestra a continuación es una aplicación típica de esta reacción:
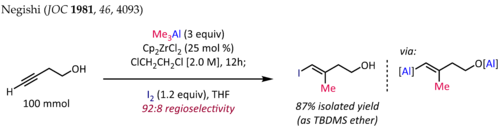
Para los alquinos terminales, la reacción generalmente transcurre con buena regioselectividad (>90:10 rr) y sin selectividad completa, incluso en presencia de sustituyentes heteroátomos propargílicos u homopropargílicos. Desafortunadamente, la extensión de la metilaluminación catalizada por circonoceno a alquilaluminación con alquilos superiores da como resultado rendimientos más bajos y regioselectividades pobres.
Aunque los miembros simples están disponibles comercialmente a bajo costo, se han desarrollado muchos métodos para su síntesis en el laboratorio, incluida la metátesis o la transmetalación .
La alta reactividad de los compuestos de organoaluminio hacia los electrófilos se atribuye a la separación de carga entre el aluminio y el átomo de carbono .
Los compuestos de organoaluminio son ácidos duros y forman fácilmente aductos con bases como piridina , THF y aminas terciarias . Estos aductos son tetraédricos en Al.
El enlace Al-C está polarizado de tal manera que el carbono es muy básico. Los ácidos reaccionan para dar alcanos. Por ejemplo, los alcoholes dan alcóxidos :
Se puede emplear una amplia variedad de ácidos además de los simples ácidos minerales. Las aminas dan derivados amido. Con dióxido de carbono , los compuestos de trialquilaluminio dan el carboxilato de dialquilaluminio y, posteriormente, los dicarboxilatos de alquilaluminio:
La conversión recuerda a la carbonatación de los reactivos de Grignard . [13] [14] [15]
De manera similar, la reacción entre compuestos de trialquilaluminio y dióxido de carbono se ha utilizado para sintetizar alcoholes, olefinas [13] o cetonas. [dieciséis]
Con oxígeno se obtienen los correspondientes alcóxidos, que pueden hidrolizarse a alcoholes:
Un peróxido orgánico de aluminio estructuralmente caracterizado es [{HC[C(Me)NC 6 H 5 ] 2 }Al(R)-OO-CMe 3 ] [R=CH(SiMe 3 ) 2 ]. [17]
La reacción entre compuestos de trialalquilaluminio puro y agua , alcoholes , fenoles , aminas , dióxido de carbono , óxidos de azufre , óxidos de nitrógeno , halógenos e hidrocarburos halogenados puede ser violenta. [18] [19]
Los compuestos organoaluminio se utilizan ampliamente en la producción de alquenos, alcoholes y polímeros. Algunos procesos relevantes incluyen el Proceso Ziegler para la producción de alcoholes a partir de etileno. Existen varias tecnologías para la oligomerización del etileno para dar alfa-olefinas. [20] Los compuestos organoaluminio se utilizan como catalizadores para la polimerización de alquenos a poliolefinas , por ejemplo el catalizador metilaluminoxano .
{{cite journal}}: Falta o está vacío |title=( ayuda )