
Un ácido de Lewis (nombrado así por el químico físico estadounidense Gilbert N. Lewis ) es una especie química que contiene un orbital vacío que es capaz de aceptar un par de electrones de una base de Lewis para formar un aducto de Lewis . Una base de Lewis , entonces, es cualquier especie que tiene un orbital lleno que contiene un par de electrones que no está involucrado en el enlace pero que puede formar un enlace dativo con un ácido de Lewis para formar un aducto de Lewis. Por ejemplo, NH 3 es una base de Lewis, porque puede donar su par solitario de electrones. El trimetilborano [(CH 3 ) 3 B] es un ácido de Lewis ya que es capaz de aceptar un par solitario. En un aducto de Lewis, el ácido y la base de Lewis comparten un par de electrones proporcionado por la base de Lewis, formando un enlace dativo. [1] En el contexto de una reacción química específica entre NH 3 y Me 3 B, un par solitario de NH 3 formará un enlace dativo con el orbital vacío de Me 3 B para formar un aducto NH 3 •BMe 3 . La terminología se refiere a las contribuciones de Gilbert N. Lewis . [2]
Los términos nucleófilo y electrófilo a veces se usan indistintamente con base de Lewis y ácido de Lewis, respectivamente. Estos términos, especialmente sus formas nominales abstractas nucleofilia y electrofilia , enfatizan el aspecto cinético de la reactividad, mientras que la basicidad de Lewis y la acidez de Lewis enfatizan el aspecto termodinámico de la formación de aductos de Lewis. [3]
En muchos casos, la interacción entre la base de Lewis y el ácido de Lewis en un complejo se indica mediante una flecha que indica la base de Lewis que dona electrones hacia el ácido de Lewis utilizando la notación de un enlace dativo , por ejemplo, Me 3 B ← NH 3 . Algunas fuentes indican la base de Lewis con un par de puntos (los electrones explícitos que se donan), lo que permite una representación consistente de la transición desde la base misma hasta el complejo con el ácido:
También se puede utilizar un punto central para representar un aducto de Lewis, como Me3B ·NH3 . Otro ejemplo es el dietileterato de trifluoruro de boro , BF3Et2O . En un uso ligeramente diferente, el punto central también se utiliza para representar la coordinación de hidratos en varios cristales, como en MgSO47H2O para el sulfato de magnesio hidratado , independientemente de si el agua forma un enlace dativo con el metal.
Aunque ha habido intentos de utilizar criterios energéticos computacionales y experimentales para distinguir el enlace dativo de los enlaces covalentes no dativos, [4] en su mayor parte, la distinción simplemente hace notar la fuente del par de electrones, y los enlaces dativos, una vez formados, se comportan simplemente como otros enlaces covalentes, aunque típicamente tienen un carácter polar considerable. Además, en algunos casos (por ejemplo, sulfóxidos y óxidos de amina como R 2 S → O y R 3 N → O ), el uso de la flecha de enlace dativo es solo una conveniencia de notación para evitar el dibujo de cargas formales. En general, sin embargo, el enlace donante-aceptor se ve simplemente como algún lugar a lo largo de un continuo entre el enlace covalente idealizado y el enlace iónico . [5]
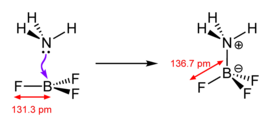
Los ácidos de Lewis son diversos y el término se utiliza con mucha ligereza. Los más simples son aquellos que reaccionan directamente con la base de Lewis, como los trihaluros de boro y los pentahaluros de fósforo, arsénico y antimonio.
En la misma línea, CH+3puede considerarse como el ácido de Lewis en las reacciones de metilación. Sin embargo, el catión metilo nunca se presenta como una especie libre en la fase condensada, y las reacciones de metilación por reactivos como CH 3 I tienen lugar a través de la formación simultánea de un enlace del nucleófilo al carbono y la ruptura del enlace entre el carbono y el yodo (reacción S N 2 ). Los libros de texto no están de acuerdo en este punto: algunos afirman que los haluros de alquilo son electrófilos pero no ácidos de Lewis, [6] mientras que otros describen los haluros de alquilo (por ejemplo, CH 3 Br) como un tipo de ácido de Lewis. [7] La IUPAC afirma que los ácidos de Lewis y las bases de Lewis reaccionan para formar aductos de Lewis, [1] y define electrófilo como ácidos de Lewis. [8]
Algunos de los ejemplos más estudiados de dichos ácidos de Lewis son los trihaluros de boro y los organoboranos : [9]
En este aducto, los cuatro centros de fluoruro (o más exactamente, los ligandos ) son equivalentes.
Tanto BF 4 − como BF 3 OMe 2 son aductos de bases de Lewis de trifluoruro de boro.
Muchos aductos violan la regla del octeto , como el anión triyoduro :
La variabilidad de los colores de las soluciones de yodo refleja las capacidades variables del disolvente para formar aductos con el ácido de Lewis I 2 .
Algunos ácidos de Lewis se unen con dos bases de Lewis, siendo un ejemplo famoso la formación de hexafluorosilicato :
La mayoría de los compuestos considerados como ácidos de Lewis requieren un paso de activación antes de la formación del aducto con la base de Lewis. Los compuestos complejos como Et3Al2Cl3 y AlCl3 se tratan como ácidos de Lewis trigonales planares pero existen como agregados y polímeros que deben ser degradados por la base de Lewis. [10] Un caso más simple es la formación de aductos de borano. El BH3 monomérico no existe de forma apreciable, por lo que los aductos de borano se generan por degradación de diborano:
En este caso, un intermedio B 2 H−7Puede aislarse.
Muchos complejos metálicos sirven como ácidos de Lewis, pero generalmente sólo después de disociar una base de Lewis unida más débilmente, a menudo agua.
El protón (H + ) [11] es uno de los ácidos de Lewis más fuertes, pero también uno de los más complicados. Es una convención ignorar el hecho de que un protón está muy solvatado (ligado al disolvente). Con esta simplificación en mente, las reacciones ácido-base pueden verse como la formación de aductos:
Un ejemplo típico de un ácido de Lewis en acción es la reacción de alquilación de Friedel-Crafts . [5] El paso clave es la aceptación por parte de AlCl 3 de un par solitario de iones cloruro, formando AlCl−4y creando el ion carbonio fuertemente ácido, es decir, electrófilo .
Una base de Lewis es una especie atómica o molecular en la que el orbital molecular más alto ocupado (HOMO) está muy localizado. Las bases de Lewis típicas son las aminas convencionales , como el amoníaco y las alquilaminas . Otras bases de Lewis comunes incluyen la piridina y sus derivados. Algunas de las principales clases de bases de Lewis son
Las bases de Lewis más comunes son los aniones. La fuerza de la basicidad de Lewis se correlaciona con el pKa del ácido original: los ácidos con pKa altos dan buenas bases de Lewis. Como es habitual, un ácido más débil tiene una base conjugada más fuerte .
Se ha evaluado la fuerza de las bases de Lewis para varios ácidos de Lewis, como I 2 , SbCl 5 y BF 3 . [12]
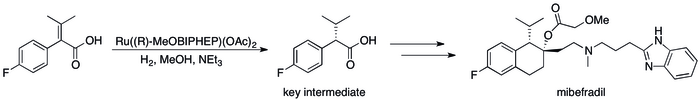
Casi todos los donantes de pares de electrones que forman compuestos mediante la unión de elementos de transición pueden considerarse ligandos . Por lo tanto, una gran aplicación de las bases de Lewis es modificar la actividad y la selectividad de los catalizadores metálicos . Las bases de Lewis quirales, generalmente multidentadas , confieren quiralidad a un catalizador, lo que permite la catálisis asimétrica , que es útil para la producción de productos farmacéuticos . La síntesis industrial del fármaco antihipertensivo mibefradil utiliza una base de Lewis quiral ( R -MeOBIPHEP), por ejemplo. [13]
Los ácidos y bases de Lewis se clasifican comúnmente según su dureza o blandura. En este contexto, duro implica átomos pequeños y no polarizables, y blando indica átomos más grandes que son más polarizables.
Por ejemplo, una amina desplazará a la fosfina del aducto con el ácido BF 3 . De la misma manera, las bases podrían clasificarse. Por ejemplo, las bases que donan un par solitario de un átomo de oxígeno son más duras que las bases que donan a través de un átomo de nitrógeno. Aunque la clasificación nunca se cuantificó, resultó ser muy útil para predecir la fuerza de la formación del aducto, utilizando los conceptos clave de que las interacciones ácido duro-base dura y ácido blando-base blanda son más fuertes que las interacciones ácido duro-base blanda o ácido blando-base dura. Investigaciones posteriores de la termodinámica de la interacción sugirieron que las interacciones duro-duro son favorecidas por la entalpía , mientras que las interacciones blando-blando son favorecidas por la entropía . [ cita requerida ]
Se han ideado muchos métodos para evaluar y predecir la acidez de Lewis. Muchos se basan en características espectroscópicas, como los cambios en las señales de RMN o las bandas de IR, por ejemplo, el método de Gutmann-Beckett y el método de Childs [14] .
El modelo ECW es un modelo cuantitativo que describe y predice la fuerza de las interacciones ácido-base de Lewis, −ΔH. El modelo asignó los parámetros E y C a muchos ácidos y bases de Lewis. Cada ácido se caracteriza por un E A y un C A . Cada base se caracteriza asimismo por su propio E B y C B . Los parámetros E y C se refieren, respectivamente, a las contribuciones electrostáticas y covalentes a la fuerza de los enlaces que formarán el ácido y la base. La ecuación es
El término W representa una contribución de energía constante para la reacción ácido-base, como la escisión de un ácido o una base diméricos. La ecuación predice la inversión de las fuerzas de los ácidos y las bases. Las representaciones gráficas de la ecuación muestran que no existe un orden único de fuerzas de bases de Lewis o de ácidos de Lewis. [15] [16] y que las escalas de propiedades individuales están limitadas a un rango más pequeño de ácidos o bases.
El concepto se originó con Gilbert N. Lewis, quien estudió el enlace químico . En 1923, Lewis escribió Una sustancia ácida es una que puede emplear un par de electrones solitarios de otra molécula para completar el grupo estable de uno de sus propios átomos. [2] [17] La teoría ácido-base de Brønsted-Lowry se publicó el mismo año. Las dos teorías son distintas pero complementarias. Una base de Lewis también es una base de Brønsted-Lowry, pero un ácido de Lewis no necesita ser un ácido de Brønsted-Lowry. La clasificación en ácidos y bases duros y blandos ( teoría HSAB ) siguió en 1963. La fuerza de las interacciones ácido-base de Lewis, medida por la entalpía estándar de formación de un aducto, se puede predecir mediante la ecuación de dos parámetros de Drago-Wayland.
Lewis había sugerido en 1916 que dos átomos se mantienen unidos en un enlace químico al compartir un par de electrones. [18] Cuando cada átomo aportaba un electrón al enlace, se denominaba enlace covalente . Cuando ambos electrones provienen de uno de los átomos, se denominaba enlace covalente dativo o enlace coordinado . La distinción no es muy clara. Por ejemplo, en la formación de un ion amonio a partir de amoniaco e hidrógeno, la molécula de amoniaco dona un par de electrones al protón ; [11] la identidad de los electrones se pierde en el ion amonio que se forma. Sin embargo, Lewis sugirió que un donante de pares de electrones se clasificara como una base y un aceptor de pares de electrones se clasificara como un ácido.
Una definición más moderna de un ácido de Lewis es una especie atómica o molecular con un orbital atómico o molecular vacío localizado de baja energía. Este orbital molecular de menor energía ( LUMO ) puede acomodar un par de electrones.
Una base de Lewis es a menudo una base de Brønsted-Lowry, ya que puede donar un par de electrones a H + ; [11] el protón es un ácido de Lewis, ya que puede aceptar un par de electrones. La base conjugada de un ácido de Brønsted-Lowry también es una base de Lewis, ya que la pérdida de H + del ácido deja los electrones que se usaron para el enlace A—H como un par solitario en la base conjugada. Sin embargo, una base de Lewis puede ser muy difícil de protonar , y aun así reaccionar con un ácido de Lewis. Por ejemplo, el monóxido de carbono es una base de Brønsted-Lowry muy débil, pero forma un aducto fuerte con BF3 .
En otra comparación de la acidez de Lewis y Brønsted–Lowry realizada por Brown y Kanner, [19] la 2,6-di- t -butilpiridina reacciona para formar la sal de clorhidrato con HCl pero no reacciona con BF 3 . Este ejemplo demuestra que los factores estéricos, además de los factores de configuración electrónica, desempeñan un papel en la determinación de la fuerza de la interacción entre la voluminosa di- t -butilpiridina y el diminuto protón.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )