
La radiación fotosintéticamente activa ( PAR ) designa el rango espectral (banda de onda) de la radiación solar de 400 a 700 nanómetros que los organismos fotosintéticos son capaces de utilizar en el proceso de fotosíntesis . Esta región espectral se corresponde más o menos con el rango de luz visible para el ojo humano. Los fotones en longitudes de onda más cortas tienden a ser tan energéticos que pueden ser dañinos para las células y los tejidos, pero en su mayoría son filtrados por la capa de ozono en la estratosfera . Los fotones en longitudes de onda más largas no transportan suficiente energía para permitir que se lleve a cabo la fotosíntesis.
Otros organismos vivos, como las cianobacterias , las bacterias púrpuras y las heliobacterias , pueden aprovechar la luz solar en regiones espectrales ligeramente extendidas, como el infrarrojo cercano . Estas bacterias viven en entornos como el fondo de estanques estancados, sedimentos y profundidades oceánicas. Debido a sus pigmentos , forman esteras coloridas de verde, rojo y púrpura.
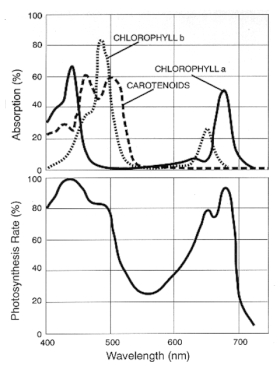
La clorofila , el pigmento vegetal más abundante, es más eficiente en la captura de luz roja y azul. Los pigmentos accesorios como los carotenos y las xantofilas recogen algo de luz verde y la pasan al proceso fotosintético, pero se reflejan suficientes longitudes de onda verdes para dar a las hojas su color característico. Una excepción al predominio de la clorofila es el otoño, cuando la clorofila se degrada (porque contiene N y Mg ) pero los pigmentos accesorios no (porque solo contienen C , H y O ) y permanecen en la hoja produciendo hojas rojas, amarillas y anaranjadas.
En las plantas terrestres, las hojas absorben principalmente la luz roja y azul en la primera capa de células fotosintéticas debido a la absorción de clorofila . Sin embargo, la luz verde penetra más profundamente en el interior de la hoja y puede impulsar la fotosíntesis de manera más eficiente que la luz roja. [1] [2] Debido a que las longitudes de onda verde y amarilla pueden transmitirse a través de la clorofila y de toda la hoja, desempeñan un papel crucial en el crecimiento debajo del dosel de la planta. [3]
La medición de la PAR se utiliza en la agricultura, la silvicultura y la oceanografía. Uno de los requisitos para que las tierras agrícolas sean productivas es una PAR adecuada, por lo que la PAR se utiliza para evaluar el potencial de inversión agrícola. Los sensores de PAR ubicados en varios niveles del dosel forestal miden el patrón de disponibilidad y utilización de PAR. La tasa fotosintética y los parámetros relacionados se pueden medir de forma no destructiva utilizando un sistema de fotosíntesis , y estos instrumentos miden la PAR y, a veces, la controlan a intensidades establecidas. Las mediciones de PAR también se utilizan para calcular la profundidad eufótica en el océano.
En estos contextos, la razón por la que se prefiere PAR sobre otras métricas de iluminación como el flujo luminoso y la iluminancia es que estas medidas se basan en la percepción humana del brillo , que tiene un fuerte sesgo verde y no describe con precisión la cantidad de luz utilizable para la fotosíntesis.
Al medir la irradiancia de PAR, los valores se expresan utilizando unidades de energía (W/m 2 ), lo cual es relevante en las consideraciones de balance energético para los organismos fotosintéticos . [4]
Sin embargo, la fotosíntesis es un proceso cuántico y las reacciones químicas de la fotosíntesis dependen más del número de fotones que de la energía contenida en los fotones. Por lo tanto, los biólogos vegetales a menudo cuantifican la PAR utilizando el número de fotones en el rango de 400-700 nm recibidos por una superficie durante una cantidad de tiempo específica, o la densidad de flujo de fotones fotosintéticos (PPFD). [4] Los valores de PPFD normalmente se expresan utilizando unidades de mol⋅m −2 ⋅s −1 . En relación con el crecimiento y la morfología de las plantas, es mejor caracterizar la disponibilidad de luz para las plantas por medio de la Integral de luz diaria (DLI), que es el flujo diario de fotones por área del suelo, e incluye tanto la variación diurna como la variación en la duración del día. [5]
La PPFD solía expresarse a veces utilizando unidades de Einstein , es decir, μE⋅m −2 ⋅s −1 , [6] aunque este uso no es estándar y ya no se utiliza. [7]

Existen dos medidas comunes de la radiación fotosintéticamente activa: el flujo de fotones fotosintéticos (PPF) y el flujo de fotones de rendimiento (YPF). El PPF valora todos los fotones de 400 a 700 nm por igual, mientras que el YPF pondera los fotones en el rango de 360 a 760 nm en función de la respuesta fotosintética de una planta. [8]
La PAR, tal como se describe con PPF, no distingue entre diferentes longitudes de onda entre 400 y 700 nm, y supone que las longitudes de onda fuera de este rango tienen una acción fotosintética cero. Si se conoce el espectro exacto de la luz, los valores de densidad de flujo de fotones fotosintéticos (PPFD) en μmol⋅s −1 ⋅m −2 ) se pueden modificar aplicando diferentes factores de ponderación a diferentes longitudes de onda. Esto da como resultado una cantidad llamada flujo de fotones de rendimiento (YPF). [8] La curva roja en el gráfico muestra que los fotones alrededor de 610 nm (rojo anaranjado) tienen la mayor cantidad de fotosíntesis por fotón. Sin embargo, debido a que los fotones de longitud de onda corta transportan más energía por fotón, la cantidad máxima de fotosíntesis por unidad de energía incidente está en una longitud de onda más larga, alrededor de 650 nm (rojo oscuro).
Se ha observado que existe un malentendido considerable sobre el efecto de la calidad de la luz en el crecimiento de las plantas. Muchos fabricantes afirman que el crecimiento de las plantas aumenta significativamente debido a la calidad de la luz (alto YPF). La curva YPF indica que los fotones naranjas y rojos entre 600 y 630 nm pueden generar entre un 20 y un 30 % más de fotosíntesis que los fotones azules o cian entre 400 y 540 nm. [9] [10] Pero la curva YPF se desarrolló a partir de mediciones a corto plazo realizadas en hojas individuales con poca luz. Estudios más recientes a largo plazo con plantas enteras con mayor luz indican que la calidad de la luz puede tener un efecto menor en la tasa de crecimiento de las plantas que la cantidad de luz. La luz azul, si bien no proporciona tantos fotones por julio, estimula el crecimiento de las hojas y afecta otros resultados. [9] [11]
La conversión entre PAR basado en energía y PAR basado en fotones depende del espectro de la fuente de luz (ver Eficiencia fotosintética ). La siguiente tabla muestra los factores de conversión de vatios para espectros de cuerpo negro que se truncan al rango de 400 a 700 nm. También muestra la eficacia luminosa para estas fuentes de luz y la fracción de un radiador de cuerpo negro real que se emite como PAR.
Por ejemplo, una fuente de luz de 1000 lm a una temperatura de color de 5800 K emitiría aproximadamente 1000/265 = 3,8 W de PAR, lo que equivale a 3,8 × 4,56 = 17,3 μmol/s. Para una fuente de luz de cuerpo negro a 5800 K, como el sol aproximadamente, una fracción de 0,368 de su radiación total emitida se emite como PAR. Para las fuentes de luz artificial, que normalmente no tienen un espectro de cuerpo negro, estos factores de conversión son solo aproximados.
Las cantidades en la tabla se calculan como
donde es el espectro de cuerpo negro según la ley de Planck , es la función de luminosidad estándar , representa el rango de longitud de onda (400–700 nm) de PAR, y es la constante de Avogadro .
Además de la cantidad de radiación que llega a una planta en la región PAR del espectro, también es importante considerar la calidad de dicha radiación. La radiación que llega a una planta contiene entropía además de energía, y combinando esos dos conceptos se puede determinar la exergía. Este tipo de análisis se conoce como análisis exergético o análisis de segunda ley, y la exergía representa una medida del trabajo útil, es decir, la parte útil de la radiación que se puede transformar en otras formas de energía.
La distribución espectral de la exergía de la radiación se define como: [12]
Una de las ventajas de trabajar con la exergía es que no sólo depende de la temperatura del emisor (el Sol), sino también de la temperatura del cuerpo receptor (la planta), es decir, incluye el hecho de que la planta esté emitiendo radiación. Nombrando y , la potencia emisora de radiación exergía en una región se determina como:
Donde es una función especial llamada polilogaritmo . Por definición, la exergía obtenida por el cuerpo receptor es siempre menor que la energía radiada por el cuerpo negro emisor, como consecuencia del contenido de entropía en la radiación. Así, como consecuencia del contenido de entropía, no toda la radiación que llega a la superficie terrestre es "útil" para producir trabajo. Por lo tanto, la eficiencia de un proceso que involucra radiación debe medirse en función de su exergía, no de su energía.
Utilizando la expresión anterior, la eficiencia óptima o eficiencia de la segunda ley para la conversión de radiación en trabajo en la región PAR [13] (de 400 nm a 700 nm), para un cuerpo negro a = 5800 K y un organismo a = 300 K se determina como:
aproximadamente un 8,3% inferior al valor considerado hasta ahora, como consecuencia directa de que los organismos que utilizan la radiación solar también emiten radiación como consecuencia de su propia temperatura. Por tanto, el factor de conversión del organismo será diferente en función de su temperatura, siendo más adecuado el concepto de exergía que el de energía.
Los investigadores de la Universidad Estatal de Utah compararon las mediciones de PPF y YPF utilizando diferentes tipos de equipos. Midieron el PPF y el YPF de siete fuentes de radiación comunes con un espectrorradiómetro y luego los compararon con las mediciones de seis sensores cuánticos diseñados para medir PPF y tres sensores cuánticos diseñados para medir YPF.
Descubrieron que los sensores PPF e YPF eran los menos precisos para fuentes de banda estrecha (espectro de luz estrecho) y los más precisos para fuentes de banda ancha (espectros de luz más completos). Descubrieron que los sensores PPF eran significativamente más precisos bajo lámparas de haluro metálico, sodio de baja presión y sodio de alta presión que los sensores YPF (>9% de diferencia). Tanto los sensores YPF como los PPF eran muy imprecisos (>18% de error) cuando se usaban para medir la luz de diodos emisores de luz roja. [8]
La radiación fotobiológicamente activa (PBAR) es un rango de energía de la luz que va más allá de la PAR e incluye dicha radiación. El flujo de fotones fotobiológico (PBF) es la métrica que se utiliza para medir la PBAR.
Muchas luces de cultivo carecen a menudo de un informe de prueba de esfera integradora, lo que significa que los valores como el flujo de fotones fotosintéticos (PPF) son adivinados por el fabricante. [ cita requerida ] Además, la publicidad falsa de los valores de eficacia de fotones fotosintéticos (PPE) (flujo de fotones fotosintéticos (PPF) μmol/W) de los fabricantes de luces de cultivo se puede evitar simplemente calculando el valor. Además, algunos fabricantes indican el valor de densidad de flujo de fotones fotosintéticos (PPFD) del diodo emisor de luz (LED) central en lugar del PPF en el área de un metro cuadrado. [ cita requerida ]
{{cite journal}}: Requiere citar revista |journal=( ayuda ) [ enlace roto ]{{cite journal}}: Requiere citar revista |journal=( ayuda )