
La biocatálisis se refiere al uso de sistemas vivos (biológicos) o sus partes para acelerar ( catalizar ) reacciones químicas. En los procesos biocatalíticos, los catalizadores naturales, como las enzimas , realizan transformaciones químicas en compuestos orgánicos . Para esta tarea se emplean tanto enzimas que han sido más o menos aisladas como enzimas que aún residen dentro de las células vivas. [1] [2] [3] La biotecnología moderna, específicamente la evolución dirigida , ha hecho posible la producción de enzimas modificadas o no naturales. Esto ha permitido el desarrollo de enzimas que pueden catalizar nuevas transformaciones de moléculas pequeñas que pueden ser difíciles o imposibles utilizando la química orgánica sintética clásica. La utilización de enzimas naturales o modificadas para realizar la síntesis orgánica se denomina síntesis quimioenzimática ; las reacciones realizadas por la enzima se clasifican como reacciones quimioenzimáticas .
La biocatálisis sustenta algunas de las transformaciones químicas más antiguas conocidas por los humanos, ya que la elaboración de cerveza es anterior a la historia registrada. Los registros más antiguos de elaboración de cerveza tienen unos 6000 años y se refieren a los sumerios .
El uso de enzimas y células enteras ha sido importante para muchas industrias durante siglos. Los usos más obvios han sido en las industrias de alimentos y bebidas, donde la producción de vino, cerveza, queso, etc. depende de los efectos de los microorganismos .
Hace más de cien años, la biocatálisis se empleaba para realizar transformaciones químicas en compuestos orgánicos no naturales creados por el hombre , y en los últimos 30 años se ha visto un aumento sustancial en la aplicación de la biocatálisis para producir productos químicos finos , especialmente para la industria farmacéutica . [4]
Dado que la biocatálisis se ocupa de enzimas y microorganismos, históricamente se la clasifica por separado de la "catálisis homogénea" y la "catálisis heterogénea". Sin embargo, desde el punto de vista mecanístico, la biocatálisis es simplemente un caso especial de catálisis heterogénea. [5]
-Las enzimas son ambientalmente benignas, degradándose completamente en el medio ambiente.
-La mayoría de las enzimas suelen funcionar en condiciones suaves o biológicas, lo que minimiza los problemas de reacciones secundarias no deseadas, como descomposición, isomerización , racemización y reordenamiento , que a menudo afectan a la metodología tradicional.
-Las enzimas seleccionadas para la síntesis quimioenzimática pueden inmovilizarse en un soporte sólido. Estas enzimas inmovilizadas demuestran una estabilidad y reutilización mejoradas.
-A través del desarrollo de la ingeniería de proteínas , específicamente la mutagénesis dirigida y la evolución dirigida, las enzimas pueden modificarse para permitir una reactividad no natural. Las modificaciones también pueden permitir una gama más amplia de sustratos, mejorar la velocidad de reacción o la renovación del catalizador.
-Las enzimas muestran una selectividad extrema hacia sus sustratos. Normalmente, las enzimas muestran tres tipos principales de selectividad:
Estas razones, y especialmente la última, son las principales razones por las que los químicos sintéticos se han interesado por la biocatálisis. Este interés, a su vez, se debe principalmente a la necesidad de sintetizar compuestos enantiopuros como bloques de construcción quirales para fármacos y agroquímicos .
El uso de la biocatálisis para obtener compuestos enantiopuros se puede dividir en dos métodos diferentes:
En la resolución cinética de una mezcla racémica, la presencia de un objeto quiral (la enzima) convierte uno de los estereoisómeros del reactivo en su producto a una velocidad de reacción mayor que la del otro estereoisómero reactivo. La mezcla estereoquímica se ha transformado en una mezcla de dos compuestos diferentes, lo que los hace separables mediante la metodología normal.
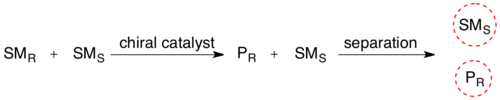
La resolución cinética biocatalizada se utiliza ampliamente en la purificación de mezclas racémicas de aminoácidos sintéticos. Muchas rutas de síntesis de aminoácidos populares, como la síntesis de Strecker , dan como resultado una mezcla de enantiómeros R y S. Esta mezcla se puede purificar (I) acilando la amina utilizando un anhídrido y luego (II) desacilando selectivamente solo el enantiómero L utilizando acilasa de riñón de cerdo. [6] Estas enzimas suelen ser extremadamente selectivas para un enantiómero, lo que conduce a diferencias muy grandes en la velocidad, lo que permite la desacilación selectiva. [7] Finalmente, los dos productos ahora se pueden separar mediante técnicas clásicas, como la cromatografía .

El rendimiento máximo en tales resoluciones cinéticas es del 50%, ya que un rendimiento de más del 50% significa que también ha reaccionado parte del isómero erróneo, lo que da lugar a un exceso enantiomérico menor . Por lo tanto, tales reacciones deben terminarse antes de que se alcance el equilibrio. Si es posible realizar tales resoluciones en condiciones en las que los dos enantiómeros del sustrato se racemizan continuamente, en teoría todo el sustrato puede convertirse en un producto enantiopuro. Esto se llama resolución dinámica .
En la síntesis asimétrica biocatalizada , una unidad no quiral se vuelve quiral de tal manera que los diferentes estereoisómeros posibles se forman en diferentes cantidades. La quiralidad se introduce en el sustrato por influencia de la enzima, que es quiral. La levadura es un biocatalizador para la reducción enantioselectiva de cetonas .
La oxidación de Baeyer-Villiger es otro ejemplo de reacción biocatalítica. En un estudio se descubrió que un mutante especialmente diseñado de Candida antarctica era un catalizador eficaz para la adición de acroleína con acetilacetona a 20 °C en ausencia de disolvente adicional. [8]
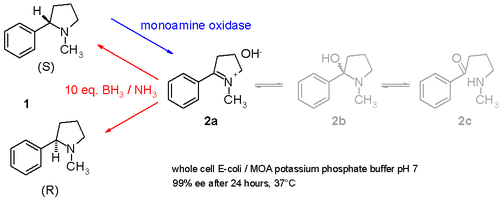
Otro estudio demuestra cómo la nicotina racémica (mezcla de enantiómeros S y R 1 en el esquema 3 ) puede desracemizarse en un procedimiento de un solo paso que involucra una monoaminooxidasa aislada de Aspergillus niger que es capaz de oxidar solo el enantiómero S de amina a la imina 2 e involucra una pareja reductora amoníaco - borano que puede reducir la imina 2 de nuevo a la amina 1. [9] De esta manera, el enantiómero S será consumido continuamente por la enzima mientras que el enantiómero R se acumula. Incluso es posible estereoinvertir S puro a R puro.
Recientemente, la catálisis fotorredox se ha aplicado a la biocatálisis, lo que permite transformaciones únicas, previamente inaccesibles. La química fotorredox depende de la luz para generar intermediarios de radicales libres . [10] Estos intermediarios radicales son aquirales, por lo que se obtienen mezclas racémicas de productos cuando no se proporciona un entorno quiral externo. Las enzimas pueden proporcionar este entorno quiral dentro del sitio activo y estabilizar una conformación particular y favorecer la formación de un producto enantiopuro. [11] Las reacciones de biocatálisis habilitadas por fotorredox se dividen en dos categorías:
Ciertos cofactores comunes de transferencia de átomos de hidrógeno ( HAT ) ( NADPH y flavina ) pueden funcionar como reactivos de transferencia de un solo electrón ( SET ). [11] [12] [13] Aunque estas especies son capaces de HAT sin irradiación, sus potenciales redox se mejoran en casi 2,0 V tras la irradiación con luz visible. [14] Cuando se combinan con sus respectivas enzimas (normalmente ene-reductasas ), los químicos han utilizado este fenómeno para desarrollar metodologías de reducción enantioselectiva. Por ejemplo, las lactamas de tamaño medio se pueden sintetizar en el entorno quiral de una ene-reductasa a través de una ciclización radical reductora, favorecida por Baldwin , terminada por HAT enantioselectiva a partir de NADPH. [15]
La segunda categoría de reacciones biocatalíticas habilitadas por fotorredox utiliza un fotocatalizador externo (PC). Se pueden utilizar muchos tipos de PC con un amplio rango de potenciales redox, lo que permite una mayor capacidad de ajuste del reactivo en comparación con el uso de un cofactor. Se utilizó rosa de Bengala y PC externo junto con una oxidorreductasa para desacilar de manera enantioselectiva alfa-acil- cetonas de tamaño mediano . [16]
El uso de un PC externo tiene algunas desventajas. Por ejemplo, los PC externos suelen complicar el diseño de la reacción porque el PC puede reaccionar tanto con el sustrato unido como con el no unido. Si se produce una reacción entre el sustrato no unido y el PC, se pierde la enantioselectividad y pueden producirse otras reacciones secundarias.
Las bioenzimas también son biocatalizadores. Se preparan mediante la fermentación de desechos orgánicos, azúcar moreno y agua en una proporción de 3:1:10 durante tres meses. Aumenta la población de microbios del suelo y acelera el compostaje y la descomposición, por lo que se incluye en los catalizadores. Cura el suelo. Es uno de los mejores fertilizantes líquidos orgánicos. Se diluye con agua.
{{cite book}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace )