

En química orgánica , la aromaticidad de Möbius es un tipo especial de aromaticidad que se cree que existe en varias moléculas orgánicas . [1] [2] En términos de la teoría de orbitales moleculares, estos compuestos tienen en común una matriz monocíclica de orbitales moleculares en la que hay un número impar de superposiciones desfasadas, el patrón opuesto en comparación con el carácter aromático de los sistemas de Hückel . El plano nodal de los orbitales, visto como una cinta, es una banda de Möbius , en lugar de un cilindro, de ahí el nombre. El patrón de energías orbitales está dado por un círculo de Frost rotado (con el borde del polígono en la parte inferior en lugar de un vértice), por lo que los sistemas con 4 n electrones son aromáticos, mientras que aquellos con 4 n + 2 electrones son antiaromáticos/no aromáticos. Debido a la naturaleza incrementalmente retorcida de los orbitales de un sistema aromático de Möbius, las moléculas aromáticas de Möbius estables necesitan contener al menos 8 electrones, aunque los estados de transición aromáticos de Möbius de 4 electrones son bien conocidos en el contexto del marco de Dewar-Zimmerman para reacciones pericíclicas . Los sistemas moleculares de Möbius fueron considerados en 1964 por Edgar Heilbronner mediante la aplicación del método de Hückel , [3] pero el primer compuesto aislable de este tipo no fue sintetizado hasta 2003 por el grupo de Rainer Herges. [4] Sin embargo, el fugaz trans- C 9 H 9 + catión, una conformación del cual se muestra a la derecha, se propuso como un intermedio reactivo aromático de Möbius en 1998 basándose en evidencia computacional y experimental.
El compuesto de Herges ( 6 en la imagen de abajo) se sintetizó en varias reacciones de cicloadición fotoquímica a partir del tetradehidrodiantraceno 1 y el ladderano sin-triciclooctadieno 2 como sustituto del ciclooctatetraeno . [nota 1]
El intermedio 5 era una mezcla de 2 isómeros y el producto final 6 una mezcla de 5 isómeros con diferentes configuraciones cis y trans . Se encontró que uno de ellos tenía una simetría molecular C 2 correspondiente a un aromático de Möbius y otro isómero de Hückel se encontró con simetría C s . A pesar de tener 16 electrones en su sistema pi (lo que lo convierte en un compuesto antiaromático 4n ) la predicción de Heilbronner se confirmó porque según Herges se encontró que el compuesto de Möbius tenía propiedades aromáticas. Con longitudes de enlace deducidas a partir de cristalografía de rayos X se obtuvo un valor HOMA de 0,50 (para la parte poliénica sola) y 0,35 para todo el compuesto, lo que lo califica como un aromático moderado.
Henry Rzepa señaló que la conversión del intermediario 5 a 6 puede realizarse mediante un estado de transición de Hückel o de Möbius . [5]
La diferencia se demostró en una reacción hipotética de apertura de anillo pericíclico con ciclododecahexaeno . La reacción de transición de Hückel (izquierda) involucra 6 electrones (flecha empujando en rojo) con simetría molecular de C s conservada a lo largo de la reacción. La apertura de anillo es disrotatoria y suprafacial y tanto la alternancia de longitud de enlace como los valores de NICS indican que el anillo de 6 miembros es aromático. La reacción de transición de Möbius con 8 electrones, por otro lado, tiene una energía de activación calculada más baja y se caracteriza por simetría de C 2 , una apertura de anillo conrotatoria y antarafacial y aromaticidad de anillo de 8 miembros.
Otro sistema interesante es el catión ciclononatetraenilo explorado durante más de 30 años por Paul v. R. Schleyer et al. Este intermediario reactivo está implicado en la solvólisis del cloruro bicíclico 9-deutero-9'-clorobiciclo[6.1.0]-nonatrieno 1 al indeno dihidroindenol 4 . [6] [7] El cloruro de partida se deutera en una sola posición, pero en el producto final el deuterio se distribuye en cada posición disponible. Esta observación se explica invocando un catión ciclononatetraenilo retorcido de 8 electrones 2 para el cual se calcula un valor NICS de -13,4 (superando al benceno ). [8] Sin embargo, un estudio más reciente sugiere que la estabilidad de trans -C 9 H 9 + no es muy diferente en energía en comparación con un isómero de topología de Hückel. El mismo estudio sugirió que para el catión [13]annulenilo, la topología de Möbius penta- trans -C 13 H 13 + es un mínimo de energía global y predice que puede ser directamente observable. [9]

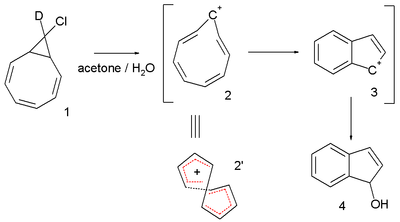
En 2005, el mismo P. v. R. Schleyer [10] cuestionó la afirmación de Herges de 2003: analizó los mismos datos cristalográficos y concluyó que efectivamente había un gran grado de alternancia de longitud de enlace que resultaba en un valor HOMA de -0,02, un valor NICS calculado de -3,4 ppm tampoco apuntaba hacia la aromaticidad y (también inferido a partir de un modelo informático) la tensión estérica impediría una superposición efectiva de orbitales pi.
Se ha descrito un cambio de aromaticidad de Hückel-Möbius (2007) basado en un sistema de porfirina de 28 electrones pi : [11] [nota 2]
Los anillos de fenileno en esta molécula son libres de girar formando un conjunto de confórmeros : uno con una media torsión de Möbius y otro con una doble torsión de Hückel (una configuración en forma de ocho) de energía aproximadamente igual.
En 2014, Zhu y Xia (con la ayuda de Schleyer) sintetizaron un sistema Möbius planar que consistía en dos anillos de penteno conectados con un átomo de osmio. [12] Formaron derivados donde el osmio tenía 16 y 18 electrones y determinaron que la aromaticidad de Craig-Möbius es más importante para la estabilización de la molécula que el recuento de electrones del metal.
En contraste con la rareza de los sistemas moleculares aromáticos de estado fundamental de Möbius , hay muchos ejemplos de estados de transición pericíclicos que exhiben aromaticidad de Möbius. La clasificación de un estado de transición pericíclico como topología de Möbius o de Hückel determina si se requieren 4 N o 4 N + 2 electrones para hacer que el estado de transición sea aromático o antiaromático y, por lo tanto, permitido o prohibido, respectivamente. Con base en los diagramas de niveles de energía derivados de la teoría de OM de Hückel , los estados de transición de Hückel de (4 N + 2) electrones y de Möbius de (4 N ) electrones son aromáticos y permitidos, mientras que los estados de transición de Möbius de (4 N + 2) electrones y de Hückel de (4 N ) electrones son antiaromáticos y prohibidos. Esta es la premisa básica del concepto de Möbius-Hückel . [13] [14]
De la figura anterior, también se puede ver que la interacción entre dos AO consecutivos se atenúa por la torsión incremental entre orbitales por , donde es el ángulo de torsión entre orbitales consecutivos, en comparación con el sistema de Hückel habitual. Por esta razón, la integral de resonancia está dada por
donde es el valor estándar de la integral de resonancia de Hückel (con orbitales completamente paralelos). Sin embargo, después de dar toda la vuelta, los orbitales N y 1 están casi completamente desfasados. (Si la torsión continuara después del orbital th, el orbital st estaría exactamente invertido en fase en comparación con el orbital 1). Por esta razón, en la matriz de Hückel la integral de resonancia entre el carbono y es .
Para el sistema de Möbius del carbono genérico, la matriz hamiltoniana es:
Ahora se pueden encontrar los valores propios de esta matriz, que corresponden a los niveles de energía del sistema de Möbius. Como es una matriz, tendremos valores propios y OM. Definición de la variable
tenemos:
Para encontrar soluciones no triviales a esta ecuación, establecemos el determinante de esta matriz en cero para obtener
Por lo tanto, encontramos los niveles de energía para un sistema cíclico con topología de Möbius,
Por el contrario, recordemos los niveles de energía para un sistema cíclico con topología de Hückel,