Las reacciones de Hajos–Parrish–Eder–Sauer–Wiechert y Barbas-List [1] en química orgánica son una familia de reacciones aldólicas asimétricas catalizadas por prolina .
En la década de 1970, dos grupos de investigación descubrieron (y publicaron) casi simultáneamente sus descubrimientos de dos reacciones intramoleculares relacionadas : Zoltan Hajos y David Parrish en Hoffmann-La Roche [2] [3] y Rudolf Wiechert et al en Schering AG . [4] El procedimiento original de Hajos-Parrish comienza con una tricetona aquiral en dimetilformamida y 3% (molar) de (S)-(−)-prolina catalítica . El producto es un cetol quiral con un exceso enantiomérico del 93% :

En la modificación de Eder-Sauer-Wiechert, el producto que se muestra arriba pierde agua para dar el alqueno conjugado .
Tres décadas después, Carlos Barbas y Benjamin List demostraron que concentraciones de catalizador más grandes podrían permitir una reacción intermolecular similar.
La reacción ha sido ampliamente utilizada en muchas síntesis moleculares enantioméricamente puras . [5] De hecho, presagió el campo moderno de la organocatálisis asimétrica .
Las investigaciones sobre la catálisis asimétrica de enaminas aplicada a intermediarios importantes en la síntesis de esteroides se deben a un creciente interés por las síntesis totales de esteroides eficientes y convenientes en la década de 1960. En particular, dos grupos industriales a principios de la década de 1970 informaron sobre reacciones aldólicas intramoleculares catalizadas por prolina.

En 1971, Escher dirigió un grupo de investigación en Schering AG que examinaba reacciones en condiciones no biológicas: (S)-Prolina (47 mol%) y ácido perclórico 1N en acetonitrilo a 80 °C. Observaron condensación hasta el alqueno conjugado, [4] pero descartaron el resultado por no ser particularmente útil. [6] Su trabajo no se volvería de conocimiento público hasta 37 años después, cuando un nuevo grupo en Schering analizó extensiones de la reacción, para entonces asociado con Hajos y Parrish. [7]
Mientras tanto, Hajos y Parrish examinaron reacciones similares en Hoffmann-La Roche bajo condiciones cuasibiológicas. Su secuencia de reacción produjo intermedios de cetol bicíclico con buen rendimiento , que, para su sorpresa, exhibieron dicroísmo circular correspondiente a un gran exceso enantiomérico . [2] [3] Un estudio de difracción de rayos X de monocristal confirmó esta hipótesis, [2] [3] mostrando un grupo metilo axial e hidroxilo ecuatorial, como en el anillo CD de la digitoxigenina : [8] [ ¿síntesis incorrecta? ]

Hajos y Parrish publicaron y patentaron sus resultados en 1974, [2] [3] y luego el campo permaneció inactivo.
En 2000, el grupo de Barbas en Scripps comenzó a investigar anticuerpos para una serie de enzimas aldolasas , conocidas por operar a través de un intermediario enamina , [9] y descubrió que uno de sus anticuerpos catalizaba una reacción intermolecular Hajos-Parrish-Eder-Saurt-Wiechert. [10] Al buscar en la literatura, notaron que Hajos et al ya habían identificado una reacción similar y comenzaron a investigar si las enaminas simples podrían sustituir a sus anticuerpos. [11] De hecho, la prolina lo hizo, aunque en concentraciones más altas que en los informes originales de la década de 1970: [12]

La oleada de investigaciones que desencadenó esta publicación aclaró múltiples cuestiones que existían desde hacía tiempo. El mecanismo de la reacción seguía siendo objeto de debate, pero el grupo de Barbas demostró que se producía mediante una catálisis combinada de iminio-enamina. [13] El colaborador de Barbas, List, también extendió la reacción a cetonas proquirales asimétricas:
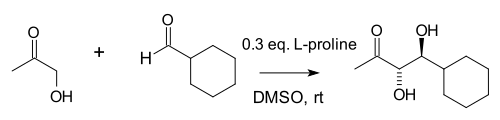
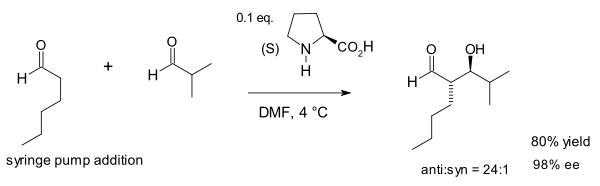
List y Notz también revelaron que la prolina y el 5,5-dimetil tiazolidinio-4-carboxilato parecían ser catalizadores óptimos dentro de un gran grupo de aminas seleccionadas . [14] En 2002, el grupo Macmillan demostró una reacción aldólica catalizada por prolina entre aldehídos . [15] Esta reacción es inusual porque, en general, los aldehídos se autocondensan.
Las sales de (S)-1-(2-pirrolidinilmetil)-pirrolidina formarían la base para el desarrollo de organocatalizadores de diamina que han demostrado ser eficaces en una amplia variedad de reacciones organocatalíticas. [16]
A lo largo de los años se han propuesto varios mecanismos de reacción para la reacción de la tricetona. Hajos y Parrish propusieron el mecanismo de enamina en su artículo [2] . Sin embargo, su experimento con una cantidad estequiométrica de agua marcada (H 2 18 O) apoyó un mecanismo de carbinolamina. Por lo tanto, Hajos propuso (1974) un intermediario hemiaminal . [2] El mecanismo de Agami (1984) tiene un intermediario de enamina con dos unidades de prolina involucradas en el estado de transición (basado en la cinética de reacción experimental ) [17] y de acuerdo con un mecanismo de Houk (2001) [18] [19] una sola unidad de prolina es suficiente con un estado de transición cíclico y con el grupo carboxilo de prolina involucrado en el enlace de hidrógeno .
El hemiaminal (carbinolamina) propuesto por Hajos en 1974 puede cambiar a un intermedio de hidróxido de iminio tautomérico. El ion hidróxido de iminio causó la enolización de la metilcetona de la cadena lateral, seguida por el cierre del anillo al producto cetol bicíclico ópticamente activo mostrado anteriormente (ver Figura 1) bajo la influencia de la cantidad catalítica de (S)-(−)-prolina. Pengxin Zhou, Long Zhang, Sanzhong Luo y Jin-Pei Cheng obtuvieron excelentes resultados utilizando la amina primaria quiral simple t-Bu-CH(NH 2 )-CH 2 -NEt 2 .TfOH para la síntesis tanto de la cetona de Wieland-Miescher como de la cetona de Hajos-Parrish, así como sus análogos. [20] Esto apoya el mecanismo del iminio, porque es química de libro de texto que las aminas primarias forman iminas en lugar de enaminas con compuestos carbonílicos.
El mecanismo de carbinolamina de Hajos 1974 ha tenido un apoyo involuntario en un artículo más reciente de Michael Limbach. [21] El material de partida de la tricetona 2-metil-2-(3-oxobutil)-1,3-ciclopentanodiona dio el cetol bicíclico ópticamente activo esperado (+)-(3aS,7aS)-3a,4,7,7a-tetrahidro-3a-hidroxi-7a-metil-1,5(6H)-indanodiona con catalizador (S)-(−)-prolina. Por otro lado, el resultado estereoquímico se invierte con selectividades ee de hasta el 83% utilizando los catalizadores de aminoácidos homólogos, como (S)-β-homoprolina, ácido [(pirrolidina-(2S)-il) acético]. La anomalía virtual se puede explicar con un enfoque del lado superior de los aminoácidos beta más voluminosos al material de partida de la tricetona anterior de simetría reflexiva. El enfoque del lado superior da como resultado la formación de una carbinolamina enantiotópica para dar el enantiómero cetol bicíclico (−)-(3aR,7aR)-3a,4,7,7a-tetrahidro-3a-hidroxi-7a-metil-1,5(6H)-indanodiona idéntico al obtenido con (R)-(+)-prolina no natural. Por otro lado, List en 2010 [22] está perplejo y sorprendido de que Hajos rechazara el mecanismo de la enamina, ciertamente a la luz del trabajo anterior de Spencer en 1965 sobre las reacciones aldólicas catalizadas por aminas. [23] Es interesante y sorprendente que Eder, Sauer y Wiechert no hayan intentado explicar el mecanismo de reacción. [3]
El mecanismo de reacción propuesto por el grupo de Barbas en 2000 para las reacciones intermoleculares [12] se basa también en la formación de enaminas y la estereoselectividad observada basada en el modelo de Zimmerman-Traxler que favorece el enfoque Re -face . Este es el mismo mecanismo propuesto por Barbas para los anticuerpos anti-aldolasa informados por el grupo en 1995:
Este mecanismo de enamina también impulsa la reacción original de tricetona de Hajos-Parrish, pero la participación de dos moléculas de prolina en ella propuesta por Agami [17] es cuestionada por Barbas basándose en la falta de efectos no lineales [16] y apoyada por estudios posteriores de List basados en la cinética de reacción . [24] El mecanismo general es apoyado además por List por el hallazgo de que en una reacción llevada a cabo en agua marcada (H 2 18 O), el isótopo de oxígeno encuentra su camino hacia el producto de reacción. [25] El experimento de Hajos y Parrish con una cantidad estequiométrica de agua marcada (H 2 18 O) apoyó el mecanismo de carbinolamina. [2]
En el mismo estudio [20] se examinó la reacción de la prolina con acetona a la oxazolidinona (en DMSO ):
La constante de equilibrio para esta reacción es sólo 0,12, lo que lleva a List a concluir que la participación de la oxazolidinona es sólo parasitaria.
En 2004, Blackmond también encontró oxazolidinonas como intermediarios (RMN) en una α-aminooxilación relacionada catalizada por prolina de propanal con nitrosobenceno : [26]
Chiong Teck Wong del Instituto de Computación de Alto Rendimiento de Singapur estudió la reacción de oxiaminación similar de nitrosobenceno con butanal utilizando un catalizador de éter de sililo prolinol quiral. [27] Sus estudios sugieren firmemente que el catalizador genera el enol y forma un complejo enol-catalizador. El nitrosobenceno reacciona posteriormente con el complejo enol-catalizador para producir el producto aldólico (S)-N-nitroso de acuerdo con el diagrama de electronegatividad de Pauling. La reducción con borohidruro de sodio de los productos aldólicos formados principalmente dio los alcoholes correspondientes con un buen rendimiento y una enantioselectividad excelente en la relación de P N /P O =>99:1 como se muestra en el Esquema a continuación. Wong sugiere que el mecanismo de reacción de la reacción aldólica N-nitroso catalizada por (S)-Cat entre nitrosobenceno y butanal se produce a través de un intermediario enólico y no a través de un intermediario enámico.
Seebach y Eschenmoser cuestionan la idea de que las oxazolidinonas son especies parásitas y en 2007 publicaron un artículo [28] en el que sostienen que las oxazolidinonas, de hecho, desempeñan un papel fundamental en la catálisis de la prolina. Una de las cosas que hicieron fue hacer reaccionar una oxazolidinona con el aldehído activado cloral en una adición aldólica:
En 2008, Barbas, en un ensayo, abordó la cuestión de por qué no se recuperó el interés por esta reacción aparentemente simple hasta el año 2000, 30 años después del trabajo pionero de Hajos y Parrish, y por qué el mecanismo de catálisis de la prolina pareció ser un enigma durante tanto tiempo. [29] Una explicación tiene que ver con diferentes culturas científicas: un mecanismo de prolina en el contexto de la catálisis de la aldolasa, postulado ya en 1964 por un bioquímico [30] , fue ignorado por los químicos orgánicos. Otra parte de la explicación fue la presunta complejidad de la catálisis de la aldolasa que dominó el pensamiento químico durante mucho tiempo. Finalmente, la investigación no se expandió en esta área en Hoffmann-La Roche después de la renuncia de ZGH en noviembre de 1970.
El nombre de esta reacción tardó algún tiempo en desarrollarse. En 1985, el profesor Agami y sus asociados fueron los primeros en denominar a la anulación de Robinson catalizada por prolina la reacción de Hajos-Parrish. [31] En 1986, el profesor Henri B. Kagan y el profesor Agami [32] todavía la llamaban reacción de Hajos-Parrish en el resumen de este artículo. En 2001, Kagan publicó un artículo titulado "Efectos no lineales en la catálisis asimétrica: un relato personal" en Synlett . [33] En este artículo, introdujo el nuevo título de reacción de Hajos-Parrish-Wiechert. En 2002, Benjamin List añadió dos nombres más e introdujo el término reacción de Hajos-Parrish-Eder-Sauer-Wiechert. [34] Los artículos científicos publicados hasta 2008 en el campo de la organocatálisis utilizan los nombres de la reacción de 1985, 2001 o 2002. Una búsqueda realizada en junio de 2014 en Google Scholar, limitada a los años 2009-2014, arroja 44 resultados para la reacción de Hajos-Parrish, 3 para la reacción de Hajos-Parrish-Wiechert y 184 para la reacción de Hajos–Parrish–Eder–Sauer–Wiechert. Sin embargo, el término «cetona de Hajos-Parrish» (y otros similares) sigue siendo común.