
El experimento de Franck-Hertz fue la primera medición eléctrica que mostró claramente la naturaleza cuántica de los átomos . Fue presentado el 24 de abril de 1914 en la Sociedad Alemana de Física en un artículo de James Franck y Gustav Hertz . [1] [2] Franck y Hertz habían diseñado un tubo de vacío para estudiar electrones energéticos que volaban a través de un vapor fino de átomos de mercurio . Descubrieron que, cuando un electrón colisionaba con un átomo de mercurio, podía perder solo una cantidad específica (4,9 electronvoltios ) de su energía cinética antes de volar. [3] Esta pérdida de energía corresponde a la desaceleración del electrón desde una velocidad de aproximadamente 1,3 millones de metros por segundo a cero. [4] Un electrón más rápido no desacelera completamente después de una colisión, sino que pierde exactamente la misma cantidad de su energía cinética. Los electrones más lentos simplemente rebotan en los átomos de mercurio sin perder ninguna velocidad o energía cinética significativa.
Estos resultados experimentales demostraron ser consistentes con el modelo de Bohr para átomos que había sido propuesto el año anterior por Niels Bohr . El modelo de Bohr fue un precursor de la mecánica cuántica y del modelo de capas electrónicas de los átomos. Su característica clave era que un electrón dentro de un átomo ocupa uno de los "niveles de energía cuántica" del átomo. Antes de la colisión, un electrón dentro del átomo de mercurio ocupaba su nivel de energía más bajo disponible. Después de la colisión, el electrón dentro ocupa un nivel de energía más alto con 4,9 electronvoltios (eV) más de energía. Esto significa que el electrón está más débilmente unido al átomo de mercurio. No había niveles intermedios ni posibilidades en el modelo cuántico de Bohr. Esta característica fue "revolucionaria" porque era incompatible con la expectativa de que un electrón pudiera estar unido al núcleo de un átomo por cualquier cantidad de energía. [3] [5]
En un segundo artículo presentado en mayo de 1914, Franck y Hertz informaron sobre la emisión de luz por los átomos de mercurio que habían absorbido energía de las colisiones. [6] Demostraron que la longitud de onda de esta luz ultravioleta correspondía exactamente a los 4,9 eV de energía que había perdido el electrón volador. La relación entre energía y longitud de onda también había sido predicha por Bohr porque había seguido la estructura presentada por Hendrik Lorentz en el Congreso Solvay de 1911. En Solvay, Hendrik Lorentz sugirió después de la charla de Einstein sobre la estructura cuántica que la energía de un rotador se estableciera igual a nhv . [7] [8] Por lo tanto, Bohr había seguido las instrucciones dadas en 1911 y había copiado la fórmula propuesta por Lorentz y otros en su modelo atómico de 1913. [ 9 ] Lorentz había estado en lo cierto. La cuantificación de los átomos coincidía con su fórmula incorporada en el modelo de Bohr. [3] Se dice que, tras una presentación de estos resultados por parte de Franck unos años más tarde, Albert Einstein comentó: "Es tan hermoso que te hace llorar". [10]
El 10 de diciembre de 1926, Franck y Hertz recibieron el Premio Nobel de Física de 1925 "por su descubrimiento de las leyes que gobiernan el impacto de un electrón sobre un átomo". [11]

El experimento original de Franck y Hertz utilizó un tubo de vacío calentado que contenía una gota de mercurio ; informaron que la temperatura del tubo era de 115 °C, en la que la presión de vapor del mercurio es de aproximadamente 100 pascales (aproximadamente una milésima parte de la presión atmosférica). [1] [12] En la fotografía se muestra un tubo de Franck-Hertz contemporáneo. Está equipado con tres electrodos: un cátodo caliente que emite electrones ; una rejilla de malla metálica ; y un ánodo . El voltaje de la rejilla es positivo en relación con el cátodo, de modo que los electrones emitidos desde el cátodo caliente son atraídos hacia él. La corriente eléctrica medida en el experimento se debe a los electrones que pasan a través de la rejilla y llegan al ánodo. El potencial eléctrico del ánodo es ligeramente negativo en relación con la rejilla, de modo que los electrones que llegan al ánodo tienen al menos una cantidad correspondiente de energía cinética después de pasar por la rejilla. [13]

Los gráficos publicados por Franck y Hertz (ver figura) muestran la dependencia de la corriente eléctrica que sale del ánodo del potencial eléctrico entre la rejilla y el cátodo.
Franck y Hertz observaron en su primer artículo que la energía característica de 4,9 eV de su experimento se correspondía bien con una de las longitudes de onda de la luz emitida por los átomos de mercurio en las descargas de gas . Estaban utilizando una relación cuántica entre la energía de excitación y la longitud de onda correspondiente de la luz, que atribuyeron ampliamente a Johannes Stark y a Arnold Sommerfeld ; predice que 4,9 eV corresponde a la luz con una longitud de onda de 254 nm. [1] La misma relación también se incorporó en la teoría de fotones de Einstein de 1905 del efecto fotoeléctrico . [15] En un segundo artículo, Franck y Hertz informaron sobre la emisión óptica de sus tubos, que emitían luz con una única longitud de onda prominente de 254 nm. [6] La figura de la derecha muestra el espectro de un tubo de Franck-Hertz; casi toda la luz emitida tiene una única longitud de onda. Como referencia, la figura también muestra el espectro de una luz de descarga de gas de mercurio, que emite luz en varias longitudes de onda además de 254 nm. La figura se basa en los espectros originales publicados por Franck y Hertz en 1914. El hecho de que el tubo de Franck-Hertz emitiera sólo la longitud de onda, correspondiente casi exactamente al período de voltaje que habían medido, fue muy importante. [13]
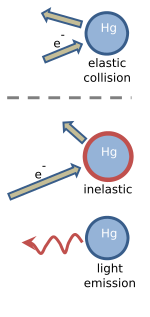
Franck y Hertz explicaron su experimento en términos de colisiones elásticas e inelásticas entre los electrones y los átomos de mercurio. [1] [2] Los electrones que se mueven lentamente chocan elásticamente con los átomos de mercurio. Esto significa que la dirección en la que se mueve el electrón se altera por la colisión, pero su velocidad no cambia. Una colisión elástica se ilustra en la figura, donde la longitud de la flecha indica la velocidad del electrón. El átomo de mercurio no se ve afectado por la colisión, principalmente porque es aproximadamente cuatrocientas mil veces más masivo que un electrón. [16] [17]
Cuando la velocidad del electrón supera los 1,3 millones de metros por segundo, [4] las colisiones con un átomo de mercurio se vuelven inelásticas. Esta velocidad corresponde a una energía cinética de 4,9 eV, que se deposita en el átomo de mercurio. Como se muestra en la figura, la velocidad del electrón se reduce y el átomo de mercurio se "excita". Poco tiempo después, los 4,9 eV de energía que se depositaron en el átomo de mercurio se liberan en forma de luz ultravioleta con una longitud de onda de exactamente 254 nm. Después de la emisión de luz, el átomo de mercurio vuelve a su estado original, no excitado. [16] [17]
Si los electrones emitidos desde el cátodo volaran libremente hasta llegar a la rejilla, adquirirían una energía cinética proporcional al voltaje aplicado a la rejilla. 1 eV de energía cinética corresponde a una diferencia de potencial de 1 voltio entre la rejilla y el cátodo. [18] Las colisiones elásticas con los átomos de mercurio aumentan el tiempo que tarda un electrón en llegar a la rejilla, pero la energía cinética promedio de los electrones que llegan allí no se ve muy afectada. [17]
Cuando el voltaje de la red alcanza los 4,9 V, las colisiones de electrones cerca de la red se vuelven inelásticas y los electrones se ralentizan considerablemente. La energía cinética de un electrón típico que llega a la red se reduce tanto que no puede viajar más lejos para alcanzar el ánodo, cuyo voltaje está configurado para repeler ligeramente a los electrones. La corriente de electrones que llega al ánodo cae, como se ve en el gráfico. Nuevos aumentos en el voltaje de la red restauran suficiente energía a los electrones que sufrieron colisiones inelásticas para que puedan volver a alcanzar el ánodo. La corriente aumenta de nuevo a medida que el potencial de la red aumenta más allá de 4,9 V. A 9,8 V, la situación cambia de nuevo. Los electrones que han viajado aproximadamente la mitad del camino desde el cátodo hasta la red ya han adquirido suficiente energía para sufrir una primera colisión inelástica. A medida que continúan lentamente hacia la red desde el punto medio, su energía cinética se acumula de nuevo, pero cuando llegan a la red pueden sufrir una segunda colisión inelástica. Una vez más, la corriente hacia el ánodo cae. Este proceso se repetirá a intervalos de 4,9 voltios; cada vez los electrones sufrirán una colisión inelástica adicional. [16] [17]
Aunque Franck y Hertz no lo sabían cuando publicaron sus experimentos en 1914 [19] , en 1913 Niels Bohr había publicado un modelo para los átomos que tuvo mucho éxito en explicar las propiedades ópticas del hidrógeno atómico. Estas se observaban habitualmente en descargas de gas, que emitían luz en una serie de longitudes de onda. Las fuentes de luz ordinarias, como las bombillas incandescentes, emiten luz en todas las longitudes de onda. Bohr había calculado las longitudes de onda emitidas por el hidrógeno con mucha precisión [20] .
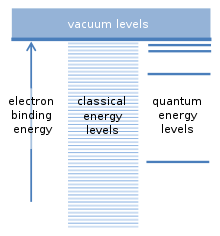
El supuesto fundamental del modelo de Bohr se refiere a las posibles energías de enlace de un electrón con el núcleo de un átomo. El átomo puede ionizarse si una colisión con otra partícula proporciona al menos esta energía de enlace. Esto libera al electrón del átomo y deja atrás un ion con carga positiva. Existe una analogía con los satélites que orbitan alrededor de la Tierra. Cada satélite tiene su propia órbita y prácticamente cualquier distancia orbital y cualquier energía de enlace de satélite son posibles. Como un electrón es atraído hacia la carga positiva del núcleo atómico por una fuerza similar, los llamados cálculos "clásicos" sugieren que cualquier energía de enlace también debería ser posible para los electrones. Sin embargo, Bohr supuso que solo existe una serie específica de energías de enlace, que corresponden a los "niveles de energía cuántica" para el electrón. Un electrón se encuentra normalmente en el nivel de energía más bajo, con la mayor energía de enlace. Los niveles adicionales se encuentran más arriba, con energías de enlace más pequeñas. Las energías de enlace intermedias que se encuentran entre estos niveles no están permitidas. Esta fue una suposición revolucionaria. [5]
Franck y Hertz habían propuesto que la característica de 4,9 V de sus experimentos se debía a la ionización de los átomos de mercurio por colisiones con los electrones volantes emitidos en el cátodo. En 1915, Bohr publicó un artículo en el que señalaba que las mediciones de Franck y Hertz eran más coherentes con el supuesto de los niveles cuánticos en su propio modelo para los átomos. [21] En el modelo de Bohr, la colisión excitaba un electrón interno dentro del átomo desde su nivel más bajo hasta el primer nivel cuántico por encima de él. El modelo de Bohr también predijo que se emitiría luz cuando el electrón interno regresara de su nivel cuántico excitado al más bajo; su longitud de onda correspondía a la diferencia de energía de los niveles internos del átomo, lo que se ha denominado la relación de Bohr. [3] La observación de Franck y Hertz de la emisión de su tubo a 254 nm también era coherente con la perspectiva de Bohr. Franck y Hertz, que escribieron después del final de la Primera Guerra Mundial en 1918, habían adoptado en gran medida la perspectiva de Bohr para interpretar su experimento, que se ha convertido en uno de los pilares experimentales de la mecánica cuántica. [10] [2] Como lo describió Abraham Pais, "la belleza del trabajo de Franck y Hertz no reside solo en la medición de la pérdida de energía E 2 - E 1 del electrón que choca, sino que también observaron que, cuando la energía de ese electrón supera los 4,9 eV, el mercurio comienza a emitir luz ultravioleta de una frecuencia definida ν como se define en la fórmula anterior. De ese modo, dieron (sin darse cuenta al principio) la primera prueba experimental directa de la relación de Bohr". [3] El propio Franck enfatizó la importancia del experimento de emisión ultravioleta en un epílogo de la película del Comité de Estudio de Ciencias Físicas (PSSC) de 1960 sobre el experimento de Franck-Hertz. [19]
En los laboratorios de instrucción, el experimento de Franck-Hertz se realiza a menudo utilizando gas neón , que muestra el inicio de colisiones inelásticas con un resplandor naranja visible en el tubo de vacío, y que también es no tóxico, en caso de que el tubo se rompa. Con tubos de mercurio, el modelo para colisiones elásticas e inelásticas predice que debería haber bandas estrechas entre el ánodo y la rejilla donde el mercurio emite luz, pero la luz es ultravioleta e invisible. Con neón, el intervalo de voltaje de Franck-Hertz es de 18,7 voltios, y aparece un resplandor naranja cerca de la rejilla cuando se aplican 18,7 voltios. Este resplandor se acercará al cátodo con un potencial de aceleración creciente e indica las ubicaciones donde los electrones han adquirido los 18,7 eV necesarios para excitar un átomo de neón. A 37,4 voltios, serán visibles dos resplandores distintos: uno a medio camino entre el cátodo y la rejilla, y otro justo en la rejilla de aceleración. Los potenciales más altos, espaciados a intervalos de 18,7 voltios, darán lugar a regiones brillantes adicionales en el tubo.
Una ventaja adicional del neón para los laboratorios de instrucción es que el tubo puede utilizarse a temperatura ambiente. Sin embargo, la longitud de onda de la emisión visible es mucho mayor que la predicha por la relación de Bohr y el intervalo de 18,7 V. Una explicación parcial de la luz naranja implica dos niveles atómicos que se encuentran 16,6 eV y 18,7 eV por encima del nivel más bajo. Los electrones excitados al nivel de 18,7 eV caen al nivel de 16,6 eV, con la consiguiente emisión de luz naranja. [22]
Luego aparecieron en rápida sucesión dos artículos de Franck y Hertz sobre mediciones del mercurio vaporizado que iban a inscribir sus nombres en los registros de la historia de la física. El primer artículo fue presentado por Gustav Hertz en la reunión de la Sociedad Alemana de Física el 24 de abril de 1914, el segundo por James Franck el 22 de mayo. (p. 45)Traducción de Aufrecht im Sturm der Zeit: der Physiker James Franck, 1882-1964 . Verlag für Geschichte der Naturwissenschaften und der Technik. 2007.ISBN 9783928186834.OCLC 234125038 .
Ahora bien, la belleza del trabajo de Franck y Hertz no reside sólo en la medición de la pérdida de energía E 2 - E 1 del electrón que choca, sino que también observaron que, cuando la energía de ese electrón supera los 4,9 eV, el mercurio comienza a emitir luz ultravioleta de una frecuencia definida ν, tal como se define en la fórmula anterior. De este modo, dieron (sin darse cuenta al principio) la primera prueba experimental directa de la relación de Bohr.La frecuencia ν está relacionada con la longitud de onda λ de la luz mediante la fórmula ν = c / λ , donde c =2,99 × 10 8 m/s es la velocidad de la luz en el vacío.
un joven danés que trabajaba en el laboratorio de Rutherford en Manchester propuso un nuevo modelo revolucionario del átomo. ... Lo que hacía que la teoría de Bohr fuera difícil de creer era la idea de estados u órbitas discretos y fijos, sin que fueran posibles estados intermedios.
Nuestra comprensión del mundo se transformó gracias a los resultados de este experimento; se podría decir que es uno de los fundamentos más importantes de la verificación experimental de la naturaleza cuántica de la materia.